CH3-CH2-CH-CH2OH (2-метилбутанол-1)
I
CH3
Химические свойства:
1. Так как это соединение спирт, для него характерна реакция горения:
2CH3-CH2-CH-CH2OH + 15О2 → 10СО2 + 12Н2О
I
CH3
Точно я не помню какие ещё реакции ему присущи, но покажу, что знаю.
2.
2CH3-CH2-CH-CH2OH +2Na → 2CH3-CH2-CH-CH2ONa + H2
I I
CH3 CH3
3. Окисление:
CH3-CH2-CH-CH2OH + CuO → CH3-CH2-CH-COH +Cu +H2O
I I
CH3 CH3
4. Качественная реакция на одноатомный спирт - это реакция с гидроксидом меди Cu(OH)2 , в результате которой осадок растворяется и раствор приобретает тёмно синий цвет.
К сожалению, это всё, что я помню. Одноатомным спиртам присущи реакции - этерификации(образование сложных эфиров), взаимодействуют с соляной кислотой к примеру.
(2,3-диметилпропановая кислота)( и кстати хочу сказать, что такого не бывает чтобы 3 метил...может ошибку какую допустил(а)..)ну на всякий случай вот..
СН2-СН-СOOH это соединение будет называться 2 метилбутановая кислота.
I I
CH3 CH3
Изомеры :
1. СН3 -СН2-СН2-СН2-СOOH (пентановая или валериановая кислота)
2. СН3-СН-СН2-СOOH (3-метилбутановая кислота)
I
CH3
3. СН3-СН2-СН-СOOH (2-метилбутановая кислота)
I
CH3
4. CH3
I
СН3-С-СOOH (2,2 - диметилпропановая кислота)
I
CH3
вот и вроде всё.
у г 1 моль
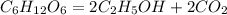
180 г 2 моль
х моль 22,4 л
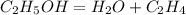
1 моль 22,4 л
1. Определим теоретически возможный объем этилена, если выход его составляет 50%(или 0,5):
V теор.=V факт./ выход продукта=11,2/0,5=22,4 л
2. Подставив этот объем во второе уравнение,вычислим количество вещества спирта во второй реакции:
при разложении 1 моль спирта образуется 22,4 л этилена, а
при -- // -- х моль________________22,4 л, откуда
х=1*11,2/22,4=1 моль
3. Подставив это количество вещества спирта в первое уравнение,и найдем массу сброженной глюкозы:
при сбраживании 180 г глюкозы образуется 2 моль спирта, а
при -- // -- у г____________________1 моль, откуда
у=180*1/2= 90 г.
Окислительно-восстановительные реакции– это реакции, сопровождающиеся переходом электронов от одних атомов или ионов к другим, другими словами – это реакции, в результате которых изменяются степени окисления элементов.
Степень окисления– это заряд атома элемента в соединении, вычисленный из условного предположения, что все связи в молекуле являются ионными.
Степень окисления принято указывать арабской цифрой над символом элемента со знаком плюс или минус перед цифрой. Например, если связь в молекуле HCl ионная, то водород и хлор ионы с зарядами (+1) и (–1), следовательно.
Для того чтобы рассчитать степень окисления любого элемента, необходимо пользоваться следующими правилами:
Степень окисления атомов в простых веществах равна нулю: (металл в свободном состоянии).Степень окисления (+1) во всех соединениях имеют щелочные металлы (IA группа) и водород, за исключением гидридов активных металлов, где степень окисления водорода равна (–1), например Степень окисления +2 во всех соединениях имеют щелочноземельные металлы (IIAгруппа).Кислород имеет степень окисления (–2), во всех соединениях, кроме пероксидов () и фторида кислорода.Алгебраическая сумма степеней окисления всех частиц в молекуле равна нулю, а в ионе – заряду иона → +1–1 = 0, .Степень окисления иона элемента равна заряду иона:Ca2+ + 2Cl1–.Не следует путать понятия «валентность» и «степень окисления». Так в N2, NH3, N2H4, NH2OH валентность (ковалентность) азота равна трем, так как азот образует три ковалентные связи, а степень окисления различна: