Короче, пишешь:
Дано:
m(Fe)= 11.2 г.
Найти:
V(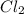 )- ?
)- ?
mр-ра(HCl)- ?
Решение
1)Пишешь саму реакцию: 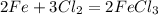
2)Определяешь количество вещества железа: n(Fe)= m(Fe)/M(Fe)= 11,2 г./56г/моль= 0,2 моль;
3)Рассчитываешь количество вещества хлора (по уравнению реакции): n(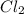 )= n(Fe)/2*3= 0,3 моль; => V(
)= n(Fe)/2*3= 0,3 моль; => V(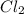 )= Vm * n(
)= Vm * n(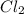 )= 22,4 л/моль * 0,3 моль= 6,72 л. Всё!
)= 22,4 л/моль * 0,3 моль= 6,72 л. Всё!
4)Пишешь уравнение реакции: 
5)Рассчитываешь количество вещества хлороводорода (по уравнению): n(HCl)= 2n(Fe)= 0,2 моль * 2= 0,4 моль;
6)mчист. в-ва(HCl)= n(HCl) * M(HCl)= 0,4 моль * 36,5 г/моль= 14,6 г.;
7)mр-ра(HCl)= mчист. в-ва(HCl)/W(HCl)/100%= 14,6 г / 0.1= 146 г. Всё!
И ответ, куда ж без него!
ответ: V(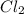 )= 6,72 л; mр-ра(HCl)= 146 г.
)= 6,72 л; mр-ра(HCl)= 146 г.
И проверь все рассчёты, а то наверняка!
Короче, пишешь:
Дано:
m(Fe)= 11.2 г.
Найти:
V(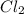 )- ?
)- ?
mр-ра(HCl)- ?
Решение
1)Пишешь саму реакцию: 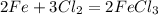
2)Определяешь количество вещества железа: n(Fe)= m(Fe)/M(Fe)= 11,2 г./56г/моль= 0,2 моль;
3)Рассчитываешь количество вещества хлора (по уравнению реакции): n(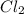 )= n(Fe)/2*3= 0,3 моль; => V(
)= n(Fe)/2*3= 0,3 моль; => V(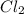 )= Vm * n(
)= Vm * n(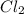 )= 22,4 л/моль * 0,3 моль= 6,72 л. Всё!
)= 22,4 л/моль * 0,3 моль= 6,72 л. Всё!
4)Пишешь уравнение реакции: 
5)Рассчитываешь количество вещества хлороводорода (по уравнению): n(HCl)= 2n(Fe)= 0,2 моль * 2= 0,4 моль;
6)mчист. в-ва(HCl)= n(HCl) * M(HCl)= 0,4 моль * 36,5 г/моль= 14,6 г.;
7)mр-ра(HCl)= mчист. в-ва(HCl)/W(HCl)/100%= 14,6 г / 0.1= 146 г. Всё!
И ответ, куда ж без него!
ответ: V(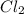 )= 6,72 л; mр-ра(HCl)= 146 г.
)= 6,72 л; mр-ра(HCl)= 146 г.
И проверь все рассчёты, а то наверняка!
V(H₂) = 37,6л.
Vm=22,4л./моль
Определить Q -?
1. Определим количество вещества водорода в его 37,6л.:
n(H₂) =V(H₂) ÷Vm = 37,6л.÷22,4л./моль = 1,68моль
3. Запишем уравнение реакции горения водорода:
2H₂ + O₂ = 2H₂O + 252кДж
4. Анализируем уравнение реакции: по уравнению при горении 2моль водорода образуется 252кДж тепла, значит при горении 1,68моль водорода будет выделятся:
Q = 1,68моль×252кДж÷2моль=211, 68кДж
5. ответ: при горении 37,6л. водорода выделяется 211,68кДж тепла.