оксиды ЭО2 в высшей степени могут создаваться из элементов IV-a группы периодической системы, потому что у них на внешнем энергетическом уровне 4 электрона. Отдавая их, элементы приобретают степень окисления + 4. В третьем периоде этот элемент силиций (кремний Si).
строение атома:+14Si 1s2 2s2 2p6 3s2 3p2
Объяснение:
атом кремния имеет три энергетических уровня. На первом размещены 2s-электрона, на втором – 2s- и 6p-электронов. На третьем (внешнем) энергетическом уровне – 2s- и 2p-электрона. Отдавая электроны внешнего уровня, кремний может создавать химические связи, проявляя степень окисления +2 или +4.
Объяснение:
1. З нерозчинним у воді 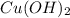 блакитного кольору утворює комплексну сполуку яскраво-блакитного кольору(прикладаю реакцію)
блакитного кольору утворює комплексну сполуку яскраво-блакитного кольору(прикладаю реакцію)
Висновок: для якісного визначення глюкози використовують важкі метали.
2. Етаналь можна визначити за до реакції "срібного дзеркала":
СН3-СНО + 2[Ag(NH3)2OH = CH3COOH + 2Ag(осад) + 4NH3 + H2O
на стінках пробірки утворюється тонкий шар срібла.
Висновок: для виявлення альдегідів можна узяти аміачний розчин аргентум(І) оксиду
Сахарозу можна виявити за реакцією:
С12H22O11 + Ca(OH)2 = C12H22O11*CaO + H2O
Cпостереження: утворення безбарвного розчину кальцій сахариту
Висновок: для виявлення сахарози необхідно узяти кальцій гідроксид
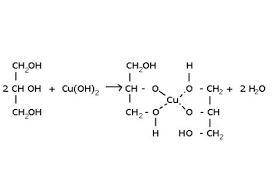
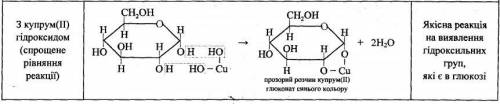
3. Для виявлення гідроксильної групи:
прикладаю фото
утворюється прозорий розчин купрум(ІІ) глюконату синього кольору
Для виявлення альдегідної групи:
CH2OH-(CHOH)4--CHO + Cu(OH)2 =(нагрівання) CH2OH-(CHOH)4-COOH + CuOH + H2O
За подальшого нагрівання утворюється осад цегляно-червоного кольору:
2CuOH = Cu2O(ocaд) + Н2О
блакитний купрум (ІІ) гідроксид розчиниться, а замість нього утвориться оранжевий осад купрум (І) гідроксиду, який за подальшого нагрівання набуде цегляно-червоного кольору.
Висновок: Щоб виявити глюкозу нам необхіден такий реактив як купрум (ІІ) гідроксид. Зазначимо те, що для виявлення альдегідної групи треба здійснити нагрівання
1s²2p⁷ -- уже неправильно, так как после 1s² идёт 2s ², кроме того 2p⁷ --тоже неправильно, так как на р- подуровне располагается максимум 6 электронов
2) 3А +2B ⇄ 2C +3D
k= [A]³*[B]²/[C]²*[D]³
при изменении концентрации
k= [3A]³*[B]²/ [2C]²*[D]³ или k= 9[A]³*[B]²/4[C]²*[D]³
Правило Ле-Шателье: Если на систему, находящуюся в равновесии оказать воздействие, то равновесие сдвинется в сторону противодействия данного воздействия