1. в виде простого вещества кислород содержится: 1) в земной коре; 2) дисциллированной воде; 3) атмосфере; 4) граните. 2. ряд чисел 2, 8, 5 соответствует распределению электронов по энергетическим уровням атома: 1) алюминия; 2) азота; 3) фосфора; 4) хлора. 3. наиболее ярко выражены неметаллические свойства: 1) у sn; 2) ge; 3) si; 4) c. 4. высшую валентность азот проявляет в оксиде: 1) n2o5; 2) no2; 3) no; 4) n2o. 5. связь в молекуле брома br2: 1) ионная; 2) металлическая; 3) ковалентная неполярная; 4) ковалентная полярная. 6. формулы оксида, основания, соли соответственно: 1) bao, fe(oh)2, nano3; 2) sio2, cao, k2co3; 3) p2o5, na2o, cacl2; 4) so3, p2o5, ca(oh)2 . 7. коэффициент перед формулой углекислого газа в уравнении реакции горения этана с2н6 в кислороде, схема которой с2н6 + о2 → со2 + н2о, равен 1) 2; 2) 3; 3) 4; 4) 5 8. уравнение реакции замещения: 1) zn + 2hcl = zncl2 + h2↑; 2) zno + h2so4 = znso4 + h2o; t 3) cu(oh)2 = cuo + h2o; 4) fe + s = fes. 9. экзотермической реакцией является: 1) с + о2 = со2; 2) 2н2о = 2н2 + о2; 3) 2hgo = 2hg + o2; 4) pcl5 = pcl3 + cl2. 10. формула вещества «х» и коэффициент перед ней в уравнении реакции, схема которой ph3 + o2 → p2o5 + x: 1) h2; 2) h2o; 3) 2h2o; 4) 3h2o. 11. при повышенной температуре водород реагирует со всеми веществами группы: 1) o2, n2, cuo; 2) h2o, o2, fe2o3; 3) o2, s, h2o; 4) h2o, cl2, wo3. 12. формулы продуктов реакции натрия с водой и коэффициенты перед ними в соответствующем уравнении реакции: 1) na2o и h2; 2) na2o и h2o; 3) 2naoh и h2; 4) naoh и h2o. 13. соль и водород могут образовываться при взаимодействии соляной кислоты: 1) с металлами (не всеми); 2) основаниями; 3) основными ; 4) кислотными . 14. гидроксид меди (ii) реагирует: 1) с h2o; 2) hno3; 3) al2o3; 4) au. 15. оксид калия реагирует: 1) с li2o; 2) cu; 3) hno3; 4) mgo. 16. формула вещества, обозначенного «х» в схеме превращений +h2 +hcl feo → x → fecl2: 1) fe2o3; 2) fecl3; 3) fe; 4) fe(oh)3. 17. элементом «э» в схеме превращений э → эо2 → н2эо3 может быть: 1) сера; 2) кальций; 3) фосфор; 4) алюминий. 18. фенолфталеин изменяет окраску при добавлении 1) к h2so4 (р-р); 2) naoh (p-p); 3) h2o; 4) cu(oh)2. 19. в лаборатории кислород получают: 1) разделением воздуха; 2) разложением перманганата калия; 3) взаимодействием метана сн4 с водой; 4) взаимодействием натрия с водой. 20. в промышленности водород не получали и не получают взаимодействием: 1) метана сн4 с н2о; 2) fe c h2o; 3) электролизом воды; 4) zn с hcl. 21. свойства воды не могут использоваться при получении: 1) металлов из их оксидов; 2) кислот из кислотных оксидов; 3) щелочей из основных оксидов; 4) водорода а и кислорода электролизом водных растворов. 22. массовая доля кислорода в серной кислоте h2so4 равна приблизительно: 1) 16 %; 2) 33 %; 3) 65 %; 4) 2 %. 23. количество водорода, выделившегося при взаимодействии 325 г цинка с соляной кислотой, равно: 1) 1 моль; 2) 3 моль; 3) 5 моль; 4) 7 моль. 24. для приготовления 5%-го раствора необходимо 2 г сахара растворить в воде, масса которой равна 1) 19 г; 2) 20 г; 3) 38 г; 4) 40 г.
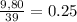
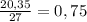
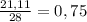
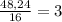
2.3
3.4
4.1
5.3
6.1
7.3
8.1
9.1
10.4
11.1
12.3
13.1
14.2
15.3
16.3
17.1
18.2
19.2
20.4
21.1
22.3
23.3
24.3