Вариант № 1 1. к раствору массой 250 г с (соли) = 10% добавили эту же соль массой 15 г. рассчитайте массовую долю соли в полученном растворе. ответ: 15,09 %. 2. смешали раствор массой 200 г с (щелочи) = 1% с раствором массой 50 г с (щелочи) = 4%. вычислите массовую долю щелочи в полученном растворе. ответ: 1,6%. 3. рассчитайте объем воды, который необходимо добавить к раствору объемом 500 мл с (naoh) = 40% ( = 1,43 г/мл) для приготовления раствора с (naoh) = 10%. ответ: 2,15 л. вариант № 2 1. к раствору массой 300 г с (znso4) = 5% добавили сульфат цинка массой 20 г. рассчитайте массовую долю znso4 в полученном растворе. ответ: 10,94%. 2. смешали раствор массой 150 г с (кон) = 5% с раствором массой 200 г с (кон) = 10%. вычислите массовую долю щелочи в полученном растворе. ответ: 7,86%. 3. рассчитайте объем воды, который необходимо добавить к раствору объемом 0,5 л с массовой долей серной кислоты 20% ( = 1,143 г/мл) для приготовления раствора с (h2so4) = 12%. ответ: 381 мл. вариант № 3 1. к раствору массой 450 г с (nacl) = 3% добавили эту же соль массой 25 г. рассчитайте массовую долю nacl в полученном растворе. ответ: 8,10%. 2. смешали раствор массой 300 г с массовой долей растворенного вещества 2% с раствором массой 140 г с массовой долей растворенного вещества 6%. вычислите массовую долю этого вещества в полученном растворе. ответ: 3,27%. 3. рассчитайте объем воды, который необходимо добавить к раствору объемом 250 мл с (hno3) = 30% ( = 1,205 г/мл) для приготовления раствора с (hno3) = 25%. ответ: 60,25 мл.



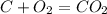 ;
;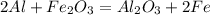 ;
;