Кислота средней силы:
{\displaystyle ~{\mathsf {H_{2}SO_{3}\rightleftarrows H^{+}+HSO_{3}^{-{\displaystyle ~{\mathsf {HSO_{3}^{-}\rightleftarrows H^{+}+SO_{3}^{2-Существует лишь в разбавленных водных растворах (в свободном состоянии не выделена):
{\displaystyle ~{\mathsf {SO_{2}+H_{2}O\rightleftarrows H_{2}SO_{3}\rightleftarrows H^{+}+HSO_{3}^{-}\rightleftarrows 2H^{+}+SO_{3}^{2-Растворы H2SO3 всегда имеют резкий специфический запах химически не связанного водой SO2.
Двухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи):
{\displaystyle {\mathsf {H_{2}SO_{3}+NaOH\longrightarrow NaHSO_{3}+H_{2}O}}}и средние — сульфиты (в избытке щёлочи):
{\displaystyle {\mathsf {H_{2}SO_{3}+2NaOH\longrightarrow Na_{2}SO_{3}+2H_{2}O}}}Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями:
{\displaystyle {\mathsf {H_{2}SO_{3}+Br_{2}+H_{2}O\longrightarrow H_{2}SO_{4}+2HBr}}}При взаимодействии с ещё более сильными восстановителями может играть роль окислителя:
{\displaystyle {\mathsf {H_{2}SO_{3}+2H_{2}S\longrightarrow 3S\downarrow +3H_{2}O}}}Качественная реакция на сульфит-ионы — обесцвечивание раствора перманганата калия:
{\displaystyle {\mathsf {5SO_{3}^{2-}+6H^{+}+2MnO_{4}^{-}\longrightarrow 5SO_{4}^{2-}+2Mn^{2+}+3H_{2}O}}}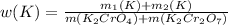
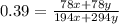
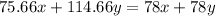
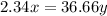
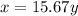
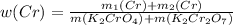
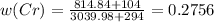 или 27.56%
или 27.56%
ω1 = 20%
m(Na2SO4*10H2O) = 4,0 г
Масса растворенного вещества Na2SO4 в первоначальном растворе
m1(Na2SO4) = [m1(р-ра)*ω1]/100% = [20,0*20]/100 = 4,0 г
Массу Na2SO4 в декагидрате Na2SO4*10H2O найдем из пропорции
m(Na2SO4*10H2O) М(Na2SO4*10H2O)
m2(Na2SO4) М(Na2SO4)
m2(Na2SO4) = m(Na2SO4*10H2O)*М(Na2SO4)/М(Na2SO4*10H2O) = 4,0*242/322 = 3,0 г
Масса растворенного вещества Na2SO4 в полученном растворе
m(Na2SO4) = m1(Na2SO4) + m2(Na2SO4) = 4,0 + 3,0 = 7,0 г
Масса полученного раствора будет складываться из массы первоначального раствора и массы растворенного в нем кристаллогидрата.
m2(p-pa) = m1(р-ра) + m(Na2SO4*10H2O) = 20,0 + 4,0 = 24,0 г
Массовая доля Na2SO4 в полученном растворе.
ω2 = [m(Na2SO4)/m2(p-pa)]*100% = [7,0/24,0]*100 = 29,2%