0 0 +1 -1
1)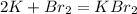
0 +1
K -1e = K |2|восстановитель(окисление)
0 -1
Br2 + 2e = 2Br |1|окислитель(восстановление)
0 0 +2 -3
2)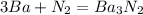
0 +2
Ba - 2e = Ba |3|восстановитель(окисление)
0 -3
N2 + 6e = 2N |1|окислитель(восстановление)
0 +1 +2 0
3)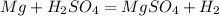
0 +2
Mg -2e = Mg |1|восстановитель(окисление)
+1 0
2H +2e = H2 |1|окислитель(восстановление)
0 +1 +1 0
4)
0 +1
Li - 1e = Li |2|восстановитель(окисление)
+1 0
2H + 2e = H2 |1|окислитель(восстановление)
0 0 +1 -1
1)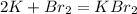
0 +1
K -1e = K |2|восстановитель(окисление)
0 -1
Br2 + 2e = 2Br |1|окислитель(восстановление)
0 0 +2 -3
2)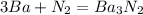
0 +2
Ba - 2e = Ba |3|восстановитель(окисление)
0 -3
N2 + 6e = 2N |1|окислитель(восстановление)
0 +1 +2 0
3)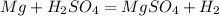
0 +2
Mg -2e = Mg |1|восстановитель(окисление)
+1 0
2H +2e = H2 |1|окислитель(восстановление)
0 +1 +1 0
4)
0 +1
Li - 1e = Li |2|восстановитель(окисление)
+1 0
2H + 2e = H2 |1|окислитель(восстановление)
m(Zn) = 40г.
Vm=22,4л./моль
V(H₂)-?
1.Оапеделим молярную массу цинка и его количество вещества в 40г.:
M(Zn)=65г./моль
n(Zn)=m(Zn) ÷M(Zn)=40г.÷65г./моль=0,6моль
2. Запишем уравнение реакции получения водорода:
Zn + 2HCI = ZnCI₂ + H₂
3. Анализируем уравнение реакции: по уравнению реакции из 1моль цинка образуется 1моль водорода, значит из0,6моль цинка образуется 0,6моль водорода. n(H₂)=0.6моль
4. Определим объем водорода количеством вещества 0,6моль:
V(H₂)=n(H₂) х Vm= 0,6моль х 22,4л./моль=13,44л.
5. ответ: из 40 г. цинка в реакции с соляной кислотой образуется 13,44л. водорода.