Объяснение:
химия 8 повторение пройденного Составьте формулы высших оксидов и гидроксидов элементов: а) К; б) Ge; в) Si. Определите их кислотно-основный характер.
а) Калий активный щелочной металл. Оксид калия К2О и и гидроксид калия КОН проявляют основные свойства. Водный раствор гидроксида калия изменяет окраску индикатора в щелочном интервале рН т.е. является щелочью.
б) Германий можно отнести к полуметаллам. Поэтому высший оксид
германия GeO2 и гидроксид германия Н2GeO3 проявляют амфотерные свойства
в) Кремний относится к неметаллам, но неметаллические свойства проявляются нечетко. Оксид кремния SiO2 в воде растворяется слабо как соответствующая ему метакремниевая кислота Н2SiO3
Кислотные свойства диоксида кремния и метакремниевой кислоты
проявляются только при сплавлении их со щелочами и карбонатами щелочных металлов. Окраску индикатора метакремниевая кислота не изменяет.
Cu - медь.
Объяснение:
При разложении гидроксида двухвалентного металла массой 19.6 г, образуется оксид двухвалентного металла массой 16 г. Определите металл. Решите с уравнения реакции.
Металл обозначим как - «Me», тогда общая формула будет : Me(OH)2, так как OH-группа является одновалентной.
Схема разложения: Me(OH)2 —> MeO + H2O
Дано:
m(MeOH)2 = 19.6 г
m(MeO) = 16 г.
m(H2O) = 19.6 - 16 = 3.6 грамм
Помним, что сумма реагентов и образующихся продуктов должна быть равной !
И так, нам известно, что воды образуется 3.6 грамм по задаче, а по реакции 18 грамм, из этого следует, что:
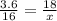
x= 80
80 грамм молекулярная масса оксида двухвалентного металла (MeO)
80-16(кислород в составе MeO) = 64 г
64 г это атомная масса Меди.
Если будут вопросы, отвечу с удовольствием в комментариях.
2Na + 2H2O = 2NaOH + H2
2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
Cu(OH)2 = CuO + H2O (термическое разложение)