Тест по теме «металлы» i вариант часть а. 1. какой металл встречается в земной коре в чистом виде: а) свинец, б) медь, в) натрий, г) железо 2. какой процесс называют пирометаллургией: а) получение металлов из растворов солей, б) получение металлов при обжиге минералов, в) получение металлов с электрического тока, г) получение металлов с бактерий 3. какие восстановители используют для восстановления металлов из их оксидов: а) с, со 2 , н 2 , б) со, н 2 , al, в) mg, со 2 , н 2 , г) fe, zn, sn 4. какие металлы относятся к щелочным: а) na, mg, al; б) k, li, na; в) ca, sr, ba; г) be, mg, ca 5. в каком ряду элементов радиус атомов увеличивается: а) k, na, li; б) be, mg, ca; в) na, mg, al; г) ca, mg, be 6. у какого металла сильнее выражены восстановительные свойства: а) al, б) na, в) mg, 7. какой из металлов используется в самолетостроении: а) железо, б) магний, в) алюминий, г) серебро 8. какая реакция относится к реакциям замещения: а) al 2 o 3 +hcl→, б) na 2 o + h 2 o→, в) fe + h 2 so 4 →, г) caco 3 →. 9. определите коэффициент перед восстановителем в уравнении: al + h 2 so 4 = al 2 (so 4 ) 3 + h 2 o а) 1, б) 2, в) 3, г) 4 10. закончите уравнение и определите сумму всех коэффициентов: na+h 2 o=… а) 4, б) 5, в) 6, г) 7 часть в. 11. установите соответствие между формулой элемента и его высшим оксидом: 1. na а) na 2 o 2 2. mg б) al 2 o 3 3. al в) pbo 4. pb г) pbo 2 д) mgo е) na 2 o 12. установите соответствие между формулой оксида и его характером: 1. к 2 о а) кислотный 2. сао б) основный 3. вео в) амфотерный 4. fe2 o 3 13. установите соответствие меду компонентами сплава и названием сплава: 1. медь и цинк а) чугун 2. медь и олово б) бронза 3. медь и никель в) латунь 4. железо и углерод г) мельхиор часть с. решите цепочку превращений: al 2 s 3 ←al→al(oh) 3 → al 2 o3 →alcl 3 решите . какую массу железа можно получить алюминотермическим методом из 1 кг оксида железа (iii), содержащего 9% примесей. тест по теме «металлы» ii вариант часть а. 1. какой металл встречается в земной коре только в виде соединений: а) серебро, б) медь, в) натрий, г) ртуть. 2. какой процесс называют гидрометаллургией: а) получение металлов из растворов солей, б) получение металлов при обжиге минералов, в) получение металлов с электрического тока, г) получение металлов с бактерий 3. какие восстановители используют для восстановления металла из соли cuso 4 : а) с, со 2 , н 2 , б) со, н 2 , al, в) mg, со 2 , н 2 , г) fe, zn, sn 4. какие металлы относятся к щелочно-земельным: а) na, mg, al; б) k, li, na; в) ca, sr, ba; г) be, mg, ca 5. в каком ряду элементов радиус атомов уменьшается: а) k, na, li; б) be, mg, ca; в) na, mg, al; г) ca, mg, be 6. какой металл не реагирует с растворами солей: а) al, б) na, в) mg, г) сu 7. какой из металлов входит в состав костной ткани: а) железо, б) магний, в) алюминий, г) кальций 8. какая реакция относится к реакциям соединения: а) al 2 o 3 +hcl→, б) na 2 o + h 2 o→, в) fe + h 2 so 4 →, г) caco 3 →. 9. определите коэффициент перед восстановителем в уравнении: са + hcl = cacl 2 + h2 o а) 1, б) 2, в) 3, г) 4 10. закончите уравнение и определите сумму всех коэффициентов: al+h 2 so 4 =… а) 4, б) 5, в) 6, г) 7 часть в. 11. установите соответствие между элементом и его электронной формулой: 1. na а) 3s 2 2. mg б) 3s 2 3p 1 3. al в) 2s 2 4. pb г) 3s 1 д) 6s 2 6p 2 е) 4s 2 4p 2 12. установите соответствие между формулой гидроксида и его характером: 1. кон а) кислотный 2. са(он) 2 б) основный 3. ве(он) 2 в) амфотерный 4. fe(oн) 3 13. установите соответствие меду формулой вещества и его названием: 1. сасо 3 а) гашеная известь 2. mgso4 б) мел 3. naoh в) магнезия 4. са(он) 2 г) едкий натр часть с. решите цепочку превращений: са → сао → са(он) 2 → саcl 2 → ca(oh) 2 → cao решите . какую массу оксида углерода (iv) можно получить при термическом разложении 1 кг природного мела (карбоната кальция) содержащего 12% примесей.
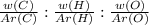 =
= 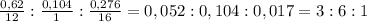
I вариант
Часть А.
1. б) медь,
*Медь относится к слабоактивным металлом, это объясняет ее возможность нахождения в самородном виде.
2. б) получение металлов при обжиге минералов.
3. б) СО, Н2, Al,
*На примере оксида железа(II) докажем восстановительную силу выбранных соединений:
FeO + CO -> Fe + CO2
FeO + H2 -> Fe + H2O
3FeO + 2Al -> 3Fe + Al2O3
4. б) K, Li, Na.
5. б) Be, Mg, Ca;
6. б) Na
*Восстановительные свойства увеличиваются справа налево по группам, сверху вниз по периодам.
7. в) алюминий.
8. в) Fe + H2SO4 →,
*Al2O3 + 6HCl → 2AlCl3 + 3H2O - обмена,
Na2O + H2O → 2NaOH - соединения,
Fe + H2SO4 → FeSO4 + H2 - замещения,
CaCO3 → CaO + CO2 - разложения.
9. б) 2,
2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
С расставленными степенями окисления:
2Al(0) + 3H2(+)S(+6)O4(-2) -> Al2(+3)(S(+6)O4(-2))3 + 3H2(0)
Al(0)--(-3ē)-->Al(+3) | 3 | ×2
- восстановитель(отдает электроны), процесс окисления
2H(+)--(+2ē)-->H2(0)|2 | ×3
- окислитель(получает электроны), процесс восстановления.
10. г) 7
*2Na + 2H2О -> 2NaOH + H2
2+2+2+1=7
Часть В.
11.
1. Na -
Е) Na2O
2. Mg -
Д) MgO
3. Al -
Б) Al2O3
4. Pb -
Г) PbO2
12.
1. К2О -
Б) основный
2. СаО -
Б) основный
3. ВеО -
В) амфотерный
4. Fe2O3 -
В) амфотерный
13.
1. медь и цинк -
В) латунь
2. медь и олово -
Б) бронза
3. медь и никель -
Г) мельхиор
4. железо и углерод -
А) чугун
Часть С.
Al2S3 ← Al → Al(OH)3 → Al2O3 → AlCl3
2Al + 3S -> Al2S3
2Al + 3Cu(OH)2 -> 2AI(OH)3 + 3Cu
2Al(OH)3 -(t°)-> Al2O3 + 3H2O
AI2O3 + 6HCI -> 2AICI3 + 3H2O
Дано:
m(Fe2O3)=1 кг
w(примеси)=9%
m(Fe)-?
1 Уравнение реакции:
2Al + Fe2O3 -> Al2O3 + 2Fe
2 Найдем массу чистого оксида железа(III):
w(Fe2O3)=100%-9%=91%
m(Fe2O3)=1×(91/100)=0.91 кг=910 г
3 Найдем количество оксида железа(III):
n=m/M
M(Fe2O3)=56×2+16×3=160 г/моль
n(Fe2O3)=910/160=5.6875 моль
4 По уравнению:
n(Fe)=2n(Fe2O3)=11.375 моль
5 Найдем массу железа:
m=n×M
M(Fe)=56 г/моль
m(Fe)=11.375×56=637 г
ответ: 637 г или 0.637 кг.
II вариант
Часть А.
1. в) натрий,
*Натрий является активным металлом, легко вступает во многие реакции, поэтому чаще всего его можно обнаружить только в виде соединений.
2. а) получение металлов из
растворов солей.
3. г) Fe, Zn, Sn
*CuSO4 + Fe -> FeSO4 + Cu
CuSO4 + Zn -> ZnSO4 + Cu
CuSO4 + Sn -> SnSO4 + Cu
4. в) Ca, Sr, Ba.
5. в) Na, Mg, Al.
6. б) Na.
7. г) кальций
8. б) Na2O + H2O →,
*Al2O3 + 6HCl → 2AlCl3 + 3H2O - обмена,
Na2O + H2O → 2NaOH - соединения,
Fe + H2SO4 → FeSO4 + H2 - замещения,
CaCO3 → CaO + CO2 - разложения.
9. а) 1,
*Са + 2HCl -> CaCl2 + H2
С расставленными степенями окисления:
Са(0) + 2H(+)Cl(-) -> Ca(+2)Cl2(-) + H2(0)
Ca(0)--(-2ē)-->Ca(+2) | 2 | ×1
- восстановитель(отдает электроны), процесс окисления
2H(+)--(+2ē)-->H2(0) | 2 | ×1
- окислитель(получает электроны), процесс восстановления.
10. -
ответ должен быть 9.
*2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
2+3+1+3=9
С расставленными степенями окисления:
2Al(0) + 3H2(+)S(+6)O4(-2) -> Al2(+3)(S(+6)O4(-2))3 + 3H2(0)
Al(0)--(-3ē)-->Al(+3) | 3 | ×2
- восстановитель(отдает электроны), процесс окисления
2H(+)--(+2ē)-->H2(0)|2 | ×3
- окислитель(получает электроны), процесс восстановления.
Часть В.
11.
1. Na -
Г) 3s 1
2. Mg -
А) 3s 2
3. Al -
Б) 3s 2 3p 1
4. Pb -
Д) 6s 2 6p 2
12.
1. КОН -
Б) основный
2. Са(ОН)2 -
Б) основный
3. Ве(ОН)2 -
В) амфотерный
4. Fe(OН)3 -
В) амфотерный
13.
1. СаСО3 -
Б) мел
2. MgSO4 -
В) магнезия
3. NaOH -
Г) едкий натр
4. Са(ОН)2 -
А) гашеная известь
Часть С.
Са → СаО → Са(ОН)2 → СаCl2 →
Ca(OH)2 → CaO
2Ca + O2 -> 2CaO
CaO + H2O -> Ca(OH)2
Ca(OH)2 + 2HCI -> CaCl2 + 2H2O
CaCl2 + 2NaOH -> 2NaCl + Ca(OH)2⬇️
Ca(OH)2 -(600°С)-> CaO + H2O
Дано:
m(CaCO3)=1 кг
w(примеси)=12%
m(CO2)-?
1 Уравнение реакции:
CaCO3 -(t°)-> CaO + CO2
2 Найдем массу чистого мела:
w(CaCO3)=100%-12%=88%
m(CaCO3)=1×(88/100)=0.88 кг=880 г
3 Найдем количество мела:
n=m/M
M(CaCO3)=40+12+16×3=100 г/моль
n(CaCO3)=880/100=8.8 моль
4 По уравнению:
n(CO2)=n(CaCO3)=8.8 моль
5 Найдем массу углекислого газа:
m=n×M
M(CO2)=12+16×2=44 г/моль
m(CO2)=8.8×44=387.2 г
ответ: 387.2 г или 0.3872 кг.