Алюминий.
1) Порядковый номер 13, 3 период, 3 группа, главная подгруппа
2) Заряд ядра +13, 13 протонов, 13 электронов, 14 нейтронов
3) 1s² 2s² 2p⁶ 3s² 3p¹ + картинка
4) Металл
5) Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера и его соединения являются амфотерными.
6) Al₂O₃ - амфотерный оксид, твердое белое вещество, тугоплавкое, нерастворимое в воде, реагирует с кислотами и щелочами в силу амфотерности
Al₂O₃ + 6HCl -> 2AlCl₃ + 3H₂O
Al₂O₃(тв) + NaOH(тв) -t-> 2NaAlO₂ + H₂O
7) Al(OH)₃ - амфотерный, нерастворимый, белое вещество
Al(OH)₃ + 2HCl -> AlCl₃ + 3H₂O
Al(OH)₃ + NaOH(изб) -> Na[Al(OH)₄]
8) Нет
Фосфор.
1) Порядковый номер 15, 3 период, 5 группа, главная подгруппа
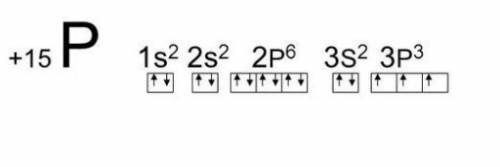
2) Заряд ядра +15, 15 протонов, 15 электронов, 16 нейтронов
3) 1s² 2s² 2s⁶ 3s² 3p² + картинка
4) Неметалл
5) Фосфор более сильный окислитель, чем As и Si, но менее слабый, чем N и S.
6) P₂O₅ - белый порошок, поглощает воду, кислотный оксид, взаимодействует с основными оксидами и основаниями
P₂O₅ + 3NaOH -> 2Na₃PO₄
P₂O₅ + 6KOH -> 2K₂PO₄ + 3H₂O
7) H₃PO₄ - гидроксид высшего оксида, бесцветная кислота, хорошо растворима в воде, взаимодействует с металлами, основными оксидами, солями слабых кислот, основаниями.
3Сa + 2H₃PO₄= Ca₃(PO₄)₂ + 3Н₂↑
оксид металла + H₃PO₄ = соль + Н₂О
H₃PO₄(изб) + 2NaOH = Na₂HPO₄ + 2H₂O
основание + H₃PO₄ = соль + Н₂О
8) Формула высшего летучего соединения RH₃ (PH₃), где R -радикал, P - фосфор
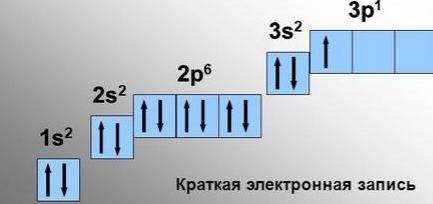
s-электроны - это электроны, расположенные на s- орбиталях. они имеют сферическую форму.
Чтобы определить, электроны, расположенные на каких подуровнях, являются валентными для элементов разных семейств, нужно записать электронную конфигурацию атома в основном состоянии. Рассмотрим на примере Li (s-элемент), S (p-элемент), Cr (d-элемент) и La (f-элемент).
Li 1s22s1,
S 1s22s22p63s23p4,
Для s-элементов валентными считаются электроны, расположенные s-орбитали, p-элементов – сумма электронов, расположенных на s- и p-орбиталях внешнего уровня; d-элементов — сумма электронов, расположенных на s- и d-орбиталях внешнего уровня; f- элементов — сумма электронов, расположенных на s- и d-орбиталях внешнего уровня.