І.Выберите три верных ответа. С водородом реагируют оба вещества в наборах: 1,3,5
ІІ.1.Сначала определим массу соли в первоначальном растворе:
m1(соли)=m1(раствора)*w1(соли)=100*0,15=15 г
2.Узнаем массу соли в новом растворе,сложив уже имеющуюся(ту,что только что определили) и добавленную:
m(соли)=m1(соли)+m2(соли)=15+50=65 г
3.Вычислим массу нового раствора,сложив массу первоначального раствора с массой добавленной соли:
m2(раствора)=m1(раствора)+m2(соли)=100+50=150 г
4. Отнеся массу соли в новом растворе к массе этого раствора,получим массовую долю соли в новом растворе:
w2(соли)=m(соли)/m2(раствора)=65/150=0,43 или 43%
ІІІ.
+7 -1 +2 0
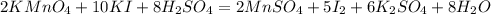
+7 +2
Mn + 5e = Mn|2| окислитель(восстановление)
-1 0
2I - 2e = I2 |5| восстановитель(окисление)
IV.
4488 г х л
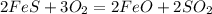
176 г 44,8 л
1. Определим чистую массу сульфида в образце:
5610 г образца - это 100%,
у г_______________80%, откуда у=5610*80/100=4488 г
2. По этой массе,подставив ее в уравнение реакции,определим объем сернистого газа:
при взаимодействии 176 г сульфида образуется 44,8 л сернистого газа, а
при --//--//-- 4488 г__________________Х л, откуда=
х=4488*44,8/176=1142 л или 1,142 м в кубе
Объяснение:
1) 2. H₂SO₄, KOH, NaCl, CO₂
2) 3. Оксид меди (ІІ) Cu --- CuO --- CuCl₂
3) 3.
4) 4. 0, -3, +2, +4, +5
N₂ ---NH₃ --- NO --- NO₂ --- HNO₃
5) 3. кислород, соляную кислоту:
2Ca + O₂ = 2CaO
CaO + 2HCl = CaCl₂ + H₂O
6) 3. 3CO + 2H₂O = CH₃OH + 2CO₂
7) 1 - Б Ba(OH)₂ - Гидроксид бария
2 - В C₂H₅OH - Этанол
3 - Г H₂SO₄ - Серная кислота
4 - Д C₄H₁₀ - Бутан
5 - А CH₃COOH - Этановая кислота
1. Сu --- CuO --- CuCl₂ --- Cu(OH)₂
2Cu + O₂ = 2CuO
CuO + 2HCl = CuCl₂ + H₂O
CuCl₂ + 2KOH = 2KCl + Cu(OH)₂
2. Ряд металла:
Hg + 2H₂SO₄ = HgSO₄ + SO₂ + 2H₂O
HgSO₄ +2KOH = K₂SO + Hg(OH)₂
Hg(OH)₂ = HgO + H₂O
2HgO = 2Hg + O₂
Ряд неметалла:
S + O₂ = SO₂
2SO₂ + O = 2SO₃
SO₃ + H₂O = H₂SO₄
H₂SO₄ + 2KOH = K₂SO₄ + 2H₂O
K₂SO₄ + BaCl₂ = BaSO₄ + 2KCl
n(NH₃) = 1,05 моль
V(CH₃COOH)р-р = 200мл
w₁(CH₃COOH) = 60% = 0,60
p = 1,064 г/мл
Найти:
w₂(CH₃COH)
Решение:
m(CH₃COOH)р-р = p×V = 1,064×200 = 212,8г
m(CH₃COOH) = 212,8×0,60 = 127,68г
Mr(NH₃) = 17 г/моль
m(NH₃) = n×Mr = 1,05×17 = 17,85г
NH₃ + CH₃COOH = CH₃COONH₄ ацетат аммония
Mr(CH₃COONH₄) = 77 г/моль
Если кислота останется в растворе, значит она в избытке.
Найдем по NH₃ массу ацетата:
m(CH₃COONH₄) = (17,85×70)÷17 = 80,85г
m(смеси)без воды = 17,85 + 127,68 = 145,53г
m₂(CH₃COOH) = 145,53 - 80,85 = 64,68г
m(смеси) = 17,85 + 212,8 = 230,65г
w₂(CH₃COOH) = 64,68÷230,65 = 0,2804×100% = 28,04%
ответ: w₂(CH₃COOH) = 28,04%