Кислоты-это електролиты,которые в водных растворах и розплавах диссоциируют на катионы Водорода и анионы кислотных остатков.За наличием атомов Кислорода их делят на кислородсодержащие(H2SO4,HNO3) и безкислородные(HCl,H2S).По количеству атомов Водорода кислоты бывают одноосновные(HNO3,HCl), двуосновные(H2CO3,H2S) и триосновные(H3PO4).По степени диссоциации кислоты делят на сильные(HCl), средней силы(H3PO4) и слабые(H2CO3)
Химические свойства:
1.Диссоциация
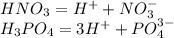
2.Взаимодействуют с основными оксидами:
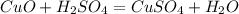
3.С основаниями(щелочами и нерастворимыми):
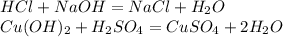
4. С амфотерными оксидами и гидроксидами:
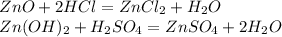
5. С солями более слабых кислот:
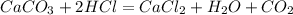
6. С металлами:

СaO + H2O -> Ca(OH)2
n=1 моль n=1 моль
М = 56 г/моль М = 74 г/моль
m=56 г m=74 г
Х г СаО - 27 г Са(ОН)2
56 г СаО - 74 г Са(ОН)2
m(CaO) = 56 * 27 / 74 = 20 г