ответ:
вы уже знаете, что электронные орбитали характеризуются разными значениями энергии, различной формой и направленностью в пространстве. так, 1s-орбиталь обладает более низкой энергией. затем следует 2s-орбиталь, более высокой энергией. обе эти орбитали имеют форму сферы. естественно, 2s-орбиталь больше 1s-орбитали: большая энергия является следствием большего среднего расстояния между электронами и ядром. три 2р-орбитали гантелеобразной формы с равной энергией направлены вдоль осей прямоугольной системы координат. следовательно, ось каждой 2р-орбитали перпендикулярна осям двух других 2р-орбиталей.
атомы углерода, входящие в состав органических соединений, могут находиться в трёх валентных состояниях.
первое валентное состояние атома углерода рассмотрим на примере молекулы метана сн4.
при образовании молекулы метана сн4 атом углерода из основного состояния переходит в возбуждённое, в котором имеет четыре неспаренных электрона: один s- и три р-электрона. эти электроны участвуют в образовании четырёх s-связей с четырьмя атомами водорода. при этом следует ожидать, что три связи с—н, образованные за счёт спаривания трёх р-электронов атомов углерода с тремя s-электронами трёх атомов водорода (s—р), должны бы отличаться от четвёртой (s—s) связи прочностью, длиной, направлением. расчёт электронной плотности в молекуле метана показывает, что все связи в его молекуле равноценны и направлены к вершинам тетраэдра. это объясняется тем, что при образовании молекулы метана ковалентные связи возникают за счёт взаимодействия не «чистых», а так называемых гибридных, т. е. усреднённых по форме и размерам (а следовательно, и по энергии), орбиталей.
1. Процесс взаимодействия уксуса с пищевой содой
является Химическим явлением - верно
CH3-COOH + NaHCO3 => CH3-COONa + H2O + CO2
образуется ацетат натрия, вода и углекислый газ
2. Химические свойства соды: белое кристаллическое
вещество без запаха - верно
3. Физические свойства уксуса: бесцветная жидкость с характерным запахом, кислым вкусом - верно
4. Пищевая сода претерпевает химические изменения при растворений В воде - верно
На самом деле при растворении пищевой соды в воде происходит электролитическая диссоциация - процесс распада цельной молекулы соды (NaHCO3) на ионы. Это происходит из-за того, что молекула воды полярна, с разных концов она имеет преимущественно "+" или "-", поэтому и растаскивают такие молекулы воды разнозаряженные ионы соды
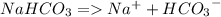
PS.: Вполне явным доказательством того, что процесс именно химической (электрохимический, если точно) - на мой взгляд служит факт того, что
- ни чистая вода, ни сода в чистом виде не проводят электроток
- раствор же соды в воде ток проводит
Cu(0) -2e -> Cu(+2) 3 ок-ие
в-ль
N(+5) +3e -> N(+2) 2 в-ие
ок-ль