KI + KIO₃ + H₂SO₄ → K₂SO₄ + I₂ + H₂O - молекулярное уравнение
K⁺ + I⁻ + K⁺ + IO₃⁻ + 2H⁺ + SO₄²⁻ → 2K⁺ + SO₄²⁻ + I₂⁰ + H₂O - Полное ионное уравнение
IO₃⁻ + 12H⁺ + 10e⁻ → I₂ + H₂O | 10 | | 1 | - Окислитель - Восстановление
| | 10 | |
2I⁻ - 2e⁻ → I₂⁰ | 2 | | 5 | - Восстановитель - Окисление
Получим:
10I⁻ + 2IO₃⁻ + 12H⁺ → 6I₂ + 6H₂O
В результате получаем вот такое уравнение:
10KI + 2KIO₃ + 6H₂SO₄ → 6K₂SO₄ + 6I₂ + 6H₂O | : 2
5KI + KIO₃ + 3H₂SO₄ → 3K₂SO₄ + 3I₂ + 3H₂O
Теперь напишем его молекулярную и ионной форме:
5KI + KIO₃ + 3H₂SO₄ → 3K₂SO₄ + 3I₂ + 3H₂O - Молекулярное уравнение
5K⁺ + 5I⁻ + K⁺ + IO₃⁻ + 6H⁺ + 3SO₄²⁻ → 6K⁺ + 3SO₄²⁻ + 3I₂ + 3H₂O - Полное ионное уравнение
5I⁻ + IO₃⁻ + 6H⁺ → 3I₂ + 3H₂O - Сокращенное ионное уравнение
Решено от : 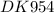
w(HgO)=4.34/12.38=0.3505*100=35%;(в остатке)
Объяснение:
Дано:
M(Hg(NO3)2)=325 г/моль;
M(HgO)=217 г/моль;
2Hg(NO3)2=>2HgO+4NO2+O2 1 реакция
Hg(NO3)2=Hg+2NO2+O2; 2 реакция
n(Hg(NO3)2)=m/M=19.5/325=0.06 моль;
нитрат ртути расходуется на обе реакции, тогда
m(Hg)+m(HgO)=12.38 г;
n(Hg)*M(Hg)+n(HgO)*M(HgO)=12.38 г; (3)
n(Hg(NO3)2)=n(Hg)=n(HgO) отсюда
n(Hg)+n(HgO)=0.06 моль;
n(Hg)=0.06- n(HgO);
Подставляем в 3 и решаем
(0.06- n(HgO))*201+n(HgO)*217=12.38 г
12.06-201n(HgO)+217n(HgO)=12.38;
0.32=16n(HgO)
n(HgO)=0.02 моль
n(Hg)=0.04 моль;
m(HgO)0.02*217=4.34 г;
m(Hg)0.04*201=8.04
w(HgO)=4.34/12.38=0.35056;(в остатке)
Магний – серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества.
Его удельная электропроводность = 22 700 000 См/м.