Дано: Решение:
m(CaCO3)=1кг 1000г-100%
w=10% 900г-90%
CaCO3+2HCl -> CaCl2 + H2O+CO2
n 1моль 1моль
M 100г/моль 111г/моль
Найти m 100г 111г
m(СаСl2)-? 900г Хг
х=(900г*111г)/100г=999г
ответ. m(CaCl2)=999г
98,4 г х л
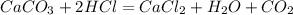
100 г 22,4 л
1.Сначала найдем чистую массу карбоната кальция в мраморе,зная,что в последнем содержится 18% примесей:
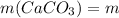 (мрамора)
(мрамора)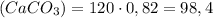 г
г
2. Теперь,подставив эту массу в уравнение реакции,определим объем углекислого газа:
При взаимодействии 100 г карбоната выделяется 22,4 л углекислого газа, а
при -- // -- 98,4 г___________________х л, откуда
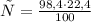 =22,04 л
=22,04 л