Химическая формула: Ca(HCO₃)₂- гидрокарбонат кальция.
Получение:Гидрокарбонат кальция получают взаимодействием карбоната кальция с углекислым газом и водой:
CaCO₃+CO₂+H₂O=Ca(H₂CO₃)₂
Объяснение:
Дано:
m(соли)=32,4г.
m(CaO)=11,2г.
m(CO₂)=17,6г.
m(H₂O)=3,6г.
Установите формулу соли-?
Назовить соль-?
Получить соль-?
1) Найдем массы каждого из элементов:
1. в оксиде
m(Ca) = 11,2*(40/56) =8г
m(O) = 11,2*(16/56) = 3,2 г
2. в углекислом газе
m(C) = 17,6*(12/44) = 4,8 г
m(O) = 17,6*(32/44) = 12,8 г
3. в воде
m(H) = 3,6*(2/18) = 0,4 г
m(O) = 3,6*(16/18) = 3,2 г
Итого:
m(Ca) = 8 г
m(C) = 4,8 г
m(H) = 0,4 г
m(O) = 19,2 г
2) Находим количества вещества каждого элемента:
n(Ca) = 8/40 = 0,2моль
n(C) = 4,8/12 = 0,4моль
n(H) = 0,4/1 = 0,4моль
nO) = 19,2/16 = 1,2моль
Приводим к целым числам
n(Ca): n(C): n(H): n(O)= 0,2моль: 0,4моль: 0,4моль: 1,2моль
n(Ca): n(C): n(H): n(O)=1моль:2моль:2моль:6
3) Брутто-формула CaH₂C₂O₆
4) Химическая формула: Ca(HCO₃)₂- гидрокарбонат кальция.
5) Получение:
Гидрокарбонат кальция получают взаимодействием карбоната кальция с углекислым газом и водой:
CaCO₃+CO₂+H₂O=Ca(H₂CO₃)₂
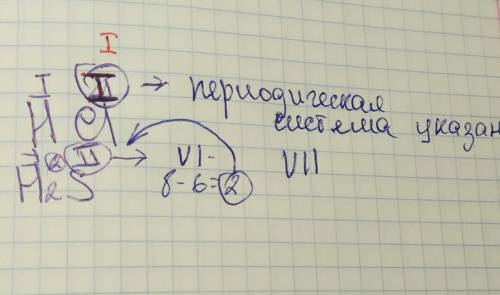
1) Углерод (С; 6) vs Натрий (Na; 11). Тут конечно Натрий имеет более выраженные металлические свойства, так как находиться в левой части таблице.
2)Фосфор (P;15) и Хлор (Cl; 17). Атомы находятся в одном периоде, соответственно Фосфор более левей расположился и потому имеет незначительно больше металлических свойств.
3) Фтор (F; 9) и Хлор (Cl; 17). Тут победитель - хлор, поскольку он находиться ниже относительно фтора.
Теоретический ответ и обоснование:
1) При перемещении вдоль периода, слева на право, металлический свойства уменьшаются. Соответственно неметаллические возрастают.
Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача.
2) При перемещении сверху вниз по группам
металлические свойства элементов усиливаются. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой "шубой" из нижних электронных оболочек и электроны внешних уровней удерживаются слабее.
3) Визуально, для быстрой оценки очень удобно представлять таблицу Менделеева в виде прямоугольника, где оранжевая часть отвечает за металлические элементы, а фиолетовая за неметаллические. А направление стрелок указывают на увеличение металлических свойств. Мне в свое время очень разобраться и запомнить данные тенденции. И да, линия смены металлов и неметаллов условная и именно по этому данная табличка не содержит каких-то границ переходных атомов. Используйте с умом.
Кремний расположен в периодической системе непосредственно под углеродом. Поэтому можно было ожидать существования кремниевых аналогов всех соединений углерода. Однако поскольку валентные электроны кремния находятся дальше от ядра и связаны с ним менее прочно, чем в атоме углерода, кремний является более электронодонорным, или металлическим , элементом по сравнению с углеродом. Поэтому кремний не образует многих типов соединений, известных для углерода. Свойства кремниевых аналогов заметно отличаются от свойств соединений углерода.
Чем обусловлены более слабо выраженные неметаллические свойства кремния по сравнению с углеродом