Напишем общую схему реакции
MeOH + H₂SO₄ → MeSO₄ + H₂O
Позначим молярную массу эквивалента металла через х, т.е. Mэкв(Me) = х г/моль
Молярная масса эквивалента гидроксогруппы - Mэкв(ОН⁻) = 17 г/моль
Молярная масса эквивалента сульфат-аниона - Mэкв(SO₄²⁻) = 48 г/моль
Отсюда, молярная масса эквивалента гидроксида металла - Mэкв(MeOH) = x + 17 г/моль
Молярная масса эквивалента сульфата металла - Mэкв(MeSO₄) = x + 48 г/моль
Пользуясь законом эквивалентов, а именно 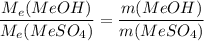 подставим все наши значения
подставим все наши значения
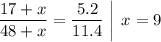
Значит молярная масса эквивалента металла - Mэкв(Me) = 9 г/моль
P.S. Это может быть, например, алюминий.
Якщо ми до 200 г початкового розчину добавили 40 г води, то маса кінцевого розчину становитиме 200 + 40 = 240 г. Отже, у нас є маса кінцевого розчину та масова частка солі у ньому. Порахуємо масу солі в кінцевому розчині
m(солі) = w₂ * m(кінцевого розчину) = 0.2 * 240 = 48 г
Так як в ході наших маніпуляцій маса солі не змінювалась, то можемо зробити висновок, що стільки ж солі було і в першому розчині. Тому можемо порахувати масову частку солі у початковому розчині
w₁ = m(солі) / m(початкового розчину) = 48 / 200 = 0.24 або 24%