ответ и решение во вложении
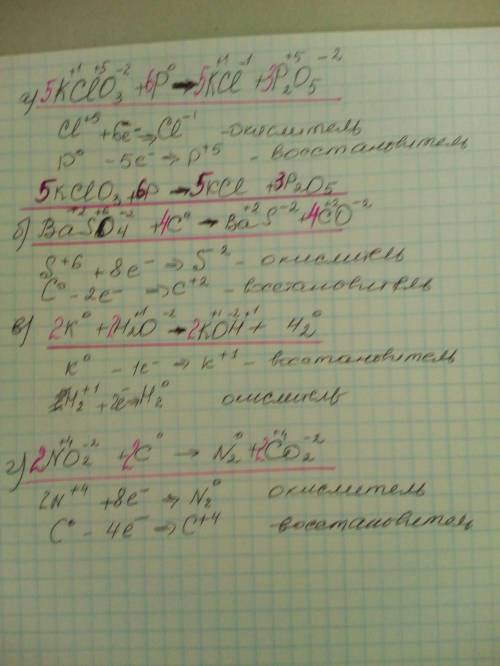
Как мы уже знаем, оксиды бывают кислотные и основные. Это деление положено в основу их классификации.
Большинство кислотных оксидов хорошо реагирует с водой, давая кислоту. Например, кислый вкус простой газированной воды объясняется образованием угольной кислоты Н2СО3 из кислотного оксида СО2:
СО2 + Н2О = Н2СО3 (угольная кислота)
В простейших случаях формулу образующейся кислоты легко получить из формулы кислотного оксида простым сложением. Например:
CO2
SO3
+
+
H2O
H2O
H2CO3
H2SO4
Однако не все кислотные оксиды растворяются в воде, поэтому не все могут непосредственно с ней реагировать. Зато все кислотные оксиды реагируют с основаниями. При этом получается сразу соль. Например:
SiO2
+
H2O
=
реакция не идет
кислотный оксид (не растворим в воде)
вода
SiO2
+
2 NaOH
=
Na2SiO3
+
H2O
кислотный оксид
щелочь
соль кремниевой кислоты H2SiO3
Полученную соль кремниевой кислоты можно превратить в саму кремниевую кислоту добавлением другой кислоты:
Na2SiO3 + 2 HCl = H2SiO3 + 2 NaCl
Таким образом, кислотному оксиду всегда соответствует определенная кислота:
CO2 (оксид углерода) – H2CO3 (угольная кислота);
SO3 (оксид серы VI) – H2SO4 (серная кислота);
SiO2 (оксид кремния) – H2SiO3 (кремниевая кислота).
Поскольку реакция с основаниями является общей для всех кислотных оксидов, им можно дать такое определение:
Оксиды, которые взаимодействуют с основаниями с образованием соли и воды, называются КИСЛОТНЫМИ ОКСИДАМИ.
** Кислотные оксиды, как мы видим, образованы в основном неметаллами. Вам следует запомнить только два оксида металлов, которые также являются кислотными. Это оксиды хрома и марганца, в которых металлы имеют НАИБОЛЬШУЮ из всех возможных степень окисления:
CrO3 (оксид хрома VI) – H2CrO4 (хромовая кислота);
Mn2O7 (оксид марганца VII) – HMnO4 (марганцовая кислота).
Основные оксиды образуются только металлами. Некоторые из них легко реагируют с водой, давая соответствующее основание:
Li2O + H2O = 2 LiOH (основание – гидроксид лития).
Еще один пример – хорошо известная нам реакция получения гашеной извести из оксида кальция и воды.
CaO + H2O = Ca(OH)2 (основание – гидроксид кальция).
Существует, однако большое количество нерастворимых основных оксидов. Их относят именно к основным оксидам благодаря реакциям с кислотами:
ZnO + H2O = реакция не идет (ZnO не растворим в воде);
ZnO + 2 HCl = ZnCl2 (соль) + H2O
Последняя реакция аналогична реакции нейтрализации между кислотой (HCl) и гидроксидом цинка Zn(OH)2, который мог бы получаться из ZnO, если бы оксид цинка растворялся в воде:
[ZnO + H2O] = Zn(OH)2
Zn(OH)2 + 2 HCl = ZnCl2 (соль) + H2O
Каждому основному оксиду соответствует определенное основание:
MgO (оксид магния) – Mg(OH)2 (гидроксид магния);
Fe2O3 (оксид железа III) – Fe(OH)3 (гидроксид железа III);
Na2O (оксид натрия) – NaOH (гидроксид натрия).
Таким образом, общее свойство основных оксидов заключается в реагировать с кислотами с образованием соли и воды.
Оксиды, которые взаимодействуют с КИСЛОТАМИ с образованием соли и воды, называются ОСНОВНЫМИ ОКСИДАМИ.
** Оксиды хрома и марганца, в которых металл имеет низшую степень окисления, являются обыкновенными основными оксидами (как и оксиды всех остальных металлов). Вот какие гидроксиды им соответствуют:
CrO (оксид хрома II) – Cr(OH)2 (гидроксид хрома II);
MnO (оксид марганца II) – Mn(OH)2 (гидроксид марганца II).
Соединения хрома (II) крайне неустойчивы и быстро переходят в соединения хрома (III). С применением многих интересных оксидов мы уже познакомились в главе 6 "кислород".
Объяснение:
а) 5KClO3 + 6P = 5KCl + 3P2O5
K(+)Cl(+5)O(-2) + P(0) = K(+)Cl(-) + P(+5)O(-2)
Cl(+5) +6e = Cl(-) 5 в-ие
ок-ль
P(0) -5e = P(+5) 6 ок-ие
в-ль
б) BaSO4 + 4C = BaS + 4CO
Ba(+2)S(+6)O(-2)+C(0) = Ba(+2)S(-2)+C(+2)O(-2)
S(+6) +8e = S(-2) 1 в-ие
ок-ль
C(0) -2e = C(+2) 4 ок-ие
в-ль
в) 2K + 2H2O = 2KOH + H2
K(0) + H(+)O(-2) = K(+)O(-2)H(+) + H(0)
K(0) -1e = K(+) 2 ок-ие
в-ль
2H(+) +2e = H2(0) 1 в-ие
ок-ль
г) 2NO2 + 2C = N2 + 2CO2
N(+4)O(-2)+C(0) = N(0) + C(+4)O(-2)
2N(+4) +8e = N2(0) 1 в-ие
ок-ль
C(0) -4e = C(+4) 2 ок-ие
в-ль