
1) Гидрирование (с образованием первичных спиртов):
H₃C-COH+H₂→H₃C-CH₂-OH
2) Присоединение гидросульфита натрия (только для алициклических):
H₃C-COH+NaHSO₃→H₃C-C-SO₃Na
|
OH
3) Присоединение синильной кислоты (образование гидроксинитрилов, или циангидринов): H₃C-COH+HCN→H₃C-CH-CN
|
OH
4) Присоединение спиртов (образование ацеталей):
R-COH+H₃-CH₂-OH⇄R-CH-O-CH₂-CH₃
| полуацеталь
OH
R-CH-O-CH₂-CH₃ R-CH-O-CH₂-CH₃
| +H₃C-CH₂-OH⇄ | ацеталь
OH O-CH₂-CH₃
5) Гидратация: CH₂=O+H₂O→H₂C(OH)₂ гидрат формальдегида
6) Присоединение реактива Гриньяра:
R-COH+H₃C-CH₂-MgI→R-CH-CH₂-CH₃
|
O-MgI
R-CH-CH₂-CH₃ R-CH-CH₂-CH₃
| +H₂O→ | +Mg(OH)I
O-MgI OH
7) Полимеризация (циклическая и линейная)
7.1) линейная: под действием света происходит линейная полимеризация 40%-ного водного раствора формальдегида с образованием параформа (картинка внизу).
7.2) циклическая: альдегиды самопроизвольно или под действием кислот могут вступать в реакции тримеризации и тетрамеризации, при этом образуются шести- и восьмичленные циклы с чередующимися атомами углерода и кислорода в молекуле (картинка внизу).
8) Поликонденсация: реакции поликонденсации – это процесс образования полимеров из низкомолекулярных веществ, сопровождающийся отщеплением побочных низкомолекулярных веществ – воды, спирта, галогеноводородов и т.д. Альдегиды вступают в реакцию поликонденсации с фенолом (анилином и т.д.) с образованием соответствующих полимерных смол. Реакции протекают ступенчато: сначала образуется димер, затем тример и т.д. (картинка внизу).
9) Конденсация (картинка внизу).
10) Горение: CnH2nO+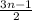 O₂→nCO₂↑+nH₂O
O₂→nCO₂↑+nH₂O
11) Реакции окисления. Альдегиды легко окисляются до кислот даже слабыми окислителями, такими как аммиачный раствор оксида серебра (Ag₂O/NH₃, или [Ag(NH₃)₂]OH), а также свежеосажденным гидроксидом меди (II):
11.1) реакция "серебряного зеркала": R-COH+2[Ag(NH₃)₂]OH→R-COONH₄ (или RCOOH) + 2Ag↓+3NH₃↑ (или 4NH₃↑)+H₂O
Исключение для формальдегида: HCOH+4[Ag(NH₃)₂]OH→(NH₄)₂CO₃+4Ag↓+6NH₃↑+2H₂O
11.2) R-COH+2Cu(OH)₂→R-COOH+Cu₂O↓+2H₂O
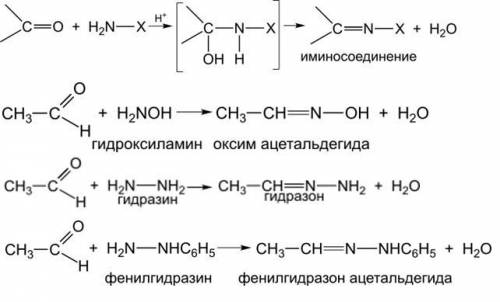
12) Реакции замещения с соединениями, содержащими аминогруппу (картинка внизу).
13) Взаимодействие с пентахлоридом фосфора:
R-COH+PCl₅→R-CH-Cl+POCl₃
|
Cl
14) Замещение атома водорода в радикале в α-положении к карбонильной группе (например, галогенирование). Сильно поляризованная карбонильная группа в молекулах альдегидов и кетонов вызывает понижение электронной плотности (δ+) на атомах углерода в α-положении, вследствие чего атомы водорода приобретают повышенную реакционную и могут отщепляться в виде протона:
H₃C-CH₂-CH₂-COH+Br₂→H₃C-CH₂-CH-COH+HBr
|
Br



1)HCl
HCl+AgNO3===>AgCl(стрелка вниз) + HNO3
H(+) + Cl(-) + Ag(+) + NO3(-)===>AgCl(стрелка вниз) + H(+) + NO3(-)
Cl(-) + Ag(+)===>AgCl(стрелка вниз)
При взаимодействии соляной кислоты с нитратом серебра выпадает белый осадок AgCl.
2)H2SO4
H2SO4+BaCl2>BaSO4(стрелка вниз) + 2HCl
2H(+) + SO4(2-) + Ba(2+) + 2Cl(-)===>BaSO4(стрелка вниз) + 2H(+) + 2Cl(-)
SO4(2-) + Ba(2+)===>BaSO4(стрелка вниз)
При взаимодействии хлорида бария с серной кислотой выпадает белый осадок BaSO4.
3)HNO3
4HNO3+Cu===>Cu(NO3)2+ 2NO2(стрелка вверх) + 2H2O
4H(+) + 4NO3(-) + Cu===>Cu(2+) + 2NO3(-) + 2NO2(стрелка вверх) + 2H2O
4H(+) + 2NO3(-) + Cu===>Cu(2+) + 2NO2(стрелка вверх) + 2H2O
При взаимодействии азотной кислоты с медью образуется раствор голубого цвета и бурый газ NO2.
n(Fe) = 9 моль
Решение
2Al + 3FeO = Al2O3 + 3Fe
Из уравнения следует, что n (Al) = 2/3 * n(Fe)
n(Al) = 2/3 * n(Fe) = 2/3 * 9 = 6 моль
m(Al) = n(Al) * M(Al) = 6 * 27 = 162 г
ответ: 162 г