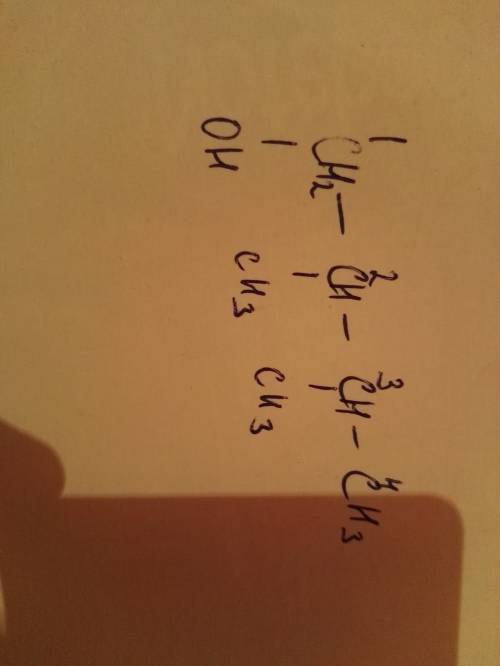
ответ: где V = 1 C .
Уравнение (26) известно в теории растворов как закон Оствальда. Для растворов слабых электролитов, у которых степень диссоциации
меньше единицы, уравнение (26) можно упростить, считая, что (1-α) ≈ 1.
Электролиты, практически полностью диссоциирующие в водных
растворах, называются сильными электролитами. К сильным
электролитам относятся: большинство солей, которые уже в
кристаллическом состоянии построены из ионов, гидроксиды S-элементов,
некоторые кислоты (HCl, HBr, HI, HClO4, HNO3).
В растворах сильных электролитов вследствие их полной диссоциации
велика концентрация ионов. Свойства таких растворов существенно
зависят от степени взаимодействия входящих в их состав ионов как друг с
другом, так и с полярными молекулами растворителя. В результате
свойства раствора, зависящие от числа растворенных частиц, такие, как
электропроводность, понижение температуры замерзания, повышение
температуры кипения и т. д., оказываются слабее, чем следовало бы
ожидать при полной диссоциации электролита на невзаимодействующие
ионы. Поэтому для описания состояния ионов в растворе наряду с
концентрацией ионов пользуются их активностью, т. е. эффективной
(активной) концентрацией, с которой они действуют в химических
процессах. Активность ионов a (моль/л) связана с их моляльной
концентрацией Cm соотношением
а = γ Сm ,
где γ – коэффициент активности.
Коэффициенты активности меняются в широких пределах. В
разбавленных растворах их значения зависят в основном от концентрации
и заряда ионов, присутствующих в растворе, т. е. от "ионной силы"
раствора I, которая равна полусумме произведений концентраций всех
ионов, присутствующих в растворе, на квадрат их заряда:
1
I=
2
∑ Ci Zi 2 .
Объяснение: α≈C ≈ K Д ⋅V .
взаимодействие идет по уравнению реакции
NH4Cl + NaOH = NaCl + NH3 + H2O
найдем какое вещество в реакции в недостатке для проведения по нему расчета
Количество веществ (хлорида аммония и гидроксида натрия) равно м=m/М, где м-количество вещества моль, m- масса вещества г, М-молекулярная масса вещества
м(NH4Cl)=m(NH4Cl)/M(NH4Cl) M(NH4Cl)=53,5г/моль
м(NH4Cl)=2,675/53,5=0,05моль
м(NaOH)=m(NaOH)/M(NaOH) M(NaOH)=40г/моль
м(NaOH)=4/40=0,1моль
из полученных вычислений следует, что хлорид аммония в недостатке относительно гидроксида натрия (0,05<0,1). В реакции оба вещесьтва участвуют в одинаковых количествах (1:1), поэтому расчет ведем по хлориду аммония
на один моль хлорида аммония приходится 1 моль аммиака
м(NH3)=м(NH4Cl)=0,05моль
Найдем объем аммиака V=м*Vм, где Vм молярный объем газа при н.у. равен 22,4л/моль
V(NH3)=м(NH3)*Vм=0.05*22.4=1.12л
ответ V(NH3)=1.12л
примечание буквенные обозначения могут отличаться от используемых в вашей школе - меняйте сами