80 при растворении в воде 57,4 г цинкового купороса (znso4 7h2o) получили 10%-ный раствор соли. к полученному раствору добавили 14,4 г магния. после завершения реакции к полученной смеси прибавили 240 г 30%-ного раствора гидроксида натрия. определите массовую долю гидроксида натрия в образовавшемся растворе. (процессами гидролиза пренебречь.)
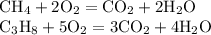
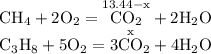
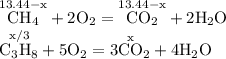
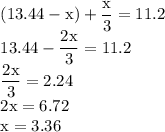
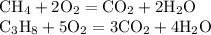
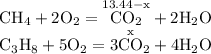
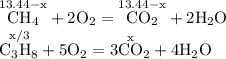
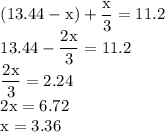
m(цинк. куп.) = 57,4 г
w(ZnSO4) = 10% = 0,1
m(Mg) = 14,4 г
m(NaOH)p = 240 г
w(NaOH) = 30% = 0,3
w(NaOH)к – ?
Решение:
Найдем массу раствора купороса из массы соли в кристаллогидрате и массовой доли в растворе сульфата цинка
m(цинк. куп.) / M(цинк. куп.) = m(ZnSO4) / M(ZnSO4)
Отсюда m(ZnSO4) = m(цинк. куп.) * M(ZnSO4) / M(цинк. куп.) = 57,4 г * 161 г/моль / 287 г/моль = 32,2 г
Отсюда m(ZnSO4)p = m(ZnSO4) / w(ZnSO4) = 32,2 г / 0,1 = 322 г
Напишем уравение следующей реакции
ZnSO4 + Mg = MgSO4 + Zn↓
Тогда найдём количество вещества магния и сульфата цинка для того, чтобы понять, что осталось в растворе
n(ZnSO4) = m(ZnSO4) / M(ZnSO4) = 32,2 г / 161 г/моль = 0,2 моль
n(Mg) = m(Mg) / M(Mg) = 14,4 г / 24 г/моль = 0,6 моль
Тогда n(Mg)к = 0,4 моль, n(Zn) = 0,2 моль, n(MgSO4) = 0,2 моль. А сульфат цинка прореагировал весь
Проведём дальнейшие реакции с гидроксидом натрия
MgSO4 + 2NaOH = Mg(OH)2 ↓ + Na2SO4
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Рассчитаем количество вещества гидроксида из его массовой доли в растворе и массы самого раствора
n(NaOH) = m(NaOH) / M(NaOH) = m(NaOH)p * w(NaOH) / M(NaOH) = 240 г * 0,3 / 40 г/моль = 1,8 моль
Тогда n(Mg(OH)2) = 0,2 моль, n(Na2SO4) = 0,2 моль, n(Н2) = 0,2 моль, n(NaOH)к = 1,8 - 0,4*2 = 1 моль
Тогда найдём массу конечного раствора
m(рк) = m(ZnSO4)p + m(Mg) - m(Mg(ОН)2) - m(H2) - m(Mg)к + m(NaOH)p
Рассчитаем массы компонентов конечного раствора
m(Mg)к = n(Mg)к * М(Мg) = 0,4 моль * 24 г/моль = 9,6 г
m(Mg(OH)2) = n(Mg(OH)2) * M(Mg(OH)2) = 0,2 моль * 58 г/моль = 11,6 г
m(H2) = n(H2) * M(H2) = 0,2 моль * 2 г/моль = 0,4 г
Посчитаем m(pк)
m(pк) = 322 + 14,4 - 11,6 - 0,4 - 9,6 + 240 = 554,8 г
Тогда посчитаем массу гидроксида конечную
m(NaOH)к = n(NaOH)к * М(NaOH) = 1 моль * 40 г/моль = 40 г
Отсюда найдём массовую долю
w(NaOH)к = m(NaOH)к / m(рк) = 40 г / 554,8 г = 0,072 или 7,2%
ответ: 7,2%
Если остались вопросы, задавайте