1.
15 - фосфор, группа пятая, период третий, подгруппа главная
33 - мышьяк, группа пятая, период 4, главная подгруппа
34 - селен (селиниум) - группа 6, период 4, подгруппа главная
54 - ксенон, группа 8, период 5, подгруппа главная
77 - иридий, группа тоже 8, период 6, подгруппа побочная
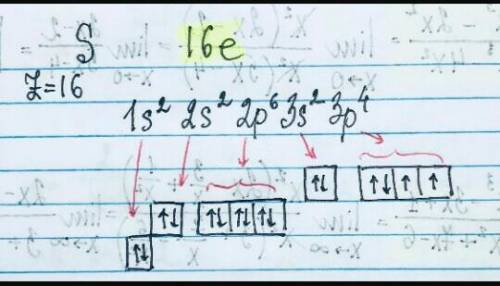
3. литий - электронная формула [He]2s1, а электронно-граф на картинке, валентный электрон 1, т.к. находится в 1 группе, относится к семейству s-элементов;
сера - [Ne] 3s² 3p⁴, электронно - граф. на картинке, валентных электронов 16, семейство халькогенов;
медь - [Ar] 3d10 4s1, электронов 11, относится к элементам d — семейства;
5.
Br2 - ковалентно неполярная связь
HCE - ковалентно полярная
Rb - металлическая
cr - металлическая связь
Zn + 2HCl → ZnCl2 + H2↑
m(HCl) = 109.5*0.1 = 10.95 г
n(HCl) = 10.95/36.5 = 0.3 моль
n(Zn) = 13/65 = 0.2 моль
Согласно уравнению реакции на реакцию с 0.2 моль цинка необходимо затратить 2*0.2 = 0.4 моль HCl, а по условию HCl в наличии имеется всего 0.3 моль HCl. Следовательно, HCl находится в недостатке и, следовательно, расчет кол-ва водорода ведем по HCl.
По уравнению реакции n(H2) = n(HCl)/2 = 0.3/2 = 0.15 моль
С учетом выхода реакции в 80 % число моль водорода уменьшится и станет равным: n(H2) = 0.15*0.8 = 0.12 моль
Тогда V(H2) = 0.12*22.4 = 2.688 л = 2688 мл