1) Сu⇒CuO⇒CuCl₂⇒Cu(OH)₂⇒CuO⇒Cu
2Cu+O₂ = 2CuO
CuO + 2HCl = CuCl₂ + H₂O
CuCl₂ + 2NaOH = Cu(OH)₂ + 2NaCl
Cu(OH)₂ = CuO + H₂O
CuO + H₂ = Cu + H₂O
2) S ⇒ SO₂ ⇒ SO₃ ⇒ H₂SO₄ ⇒ BaSO₄
S+O₂ = SO₂
2SO₂ + O₂ = 2SO₃
SO₃ + H₂O = H₂SO₄
H₂SO₄ + BaCl₂ = BaSO₄ + 2HCl
3) P ⇒ P₂O₅ ⇒ H₃PO₄ ⇒ AlPO₄
4P + 5O₂ = 2P₂O₅
P₂O₅ + 3H₂O = 2H₃PO₄
H₃PO₄ + Al(OH)₃ = AlPO₄ + 3H₂O
4) Li ⇒ Li₂O ⇒ LiOH ⇒ LiCl ⇒ LiNO₃
4Li + O₂ = 2Li₂O
Li₂O + H₂O = 2LiOH
LiOH + HCl = LiCl + H₂O
LiCl + AgNO₃ = LiNO₃ + AgCl
5) C ⇒ CO ⇒ CO₂ ⇒ CaCO₃ ⇒ CaO ⇒ Ca(OH)₂
2C + O₂ = 2CO
2CO + O₂ = 2CO₂
CO₂ + Ca(OH)₂ = CaCO₃ + H₂O
CaCO₃ = CaO + H₂O
CaO + H₂O = Ca(OH)₂
Уравнение реакции:
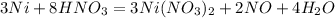
Масса раствора азотной кислоты:
m(р-ра HNO3) = 120*1.2 = 144 г.
Согласно справочным данным, раствор азотной кислоты плотности 1.2 г/см^3 имеет концентрацию (массовую долю) азотной кислоты w = 33%. Рассчитаем массу чистой азотной кислоты, пошедшей на реакцию:
m(HNO3) = 144*0.33 = 47.52 г.
Количество вещества азотной кислоты:
n(HNO3) = 47.52 / 63 = 0.75 моль.
Количество вещества никеля:
n(Ni) = 3/8 * 0.75 = 0.28 моль.
Масса чистого никеля:
m(Ni) = 0.28 * 59 = 16.52 г.
Масса 98% никеля:
m(98% Ni) = 16.52 / 0.98 = 16.86 г.
Дано: смесь СО(г) +Н₂(г)
Dсм(Не) < 2,4
η(СН₃ОН) (г) = 80 %
Dсм(Не) > 2,6
Найти: φ(Н₂)
Решение
Молярные массы: М(Не) = 4 г/моль; М(Н₂) = 2*1 = 2 г/моль; М(СО) = 12+16 = 28 г/моль; М(СН₃ОН) = 12+4+16 = 32 г/моль
1). Оценим состав смеси до реакции
Dсм(Не) = Мсм/М(Не) ⇒ Мсм = D * М(Не)
Мсм < 2,4 *4 ; ⇒ Мсм < 9,6 (г/моль)
28 *Х + 2*(1-Х) = (26Х + 2) (г/моль) молярная масса смеси
Х мольная доля угарного газа (она удобнее для вычислений) ⇒
(1 - Х) мольная доля водорода ⇒
28 * Х + 2 * (1 - Х) = 26Х + 2 молярная масса смеси
26Х + 2 < 9,6 ⇒ Х < (9,6-2)/26; Х < 0,2(923076)
СО + 2Н₂ (кат.)---> CН₃ОН
Согласно реакции соотношение СО : Н₂ = 1 : 2, т.е. мольная доля СО должна быть равна 1/3, но 1/3 > 0,2(923076), значит, водород в смеси в избытке и дальнейшие расчеты по СО
2) Оценим состав смеси после реакции
Выход спирта по условию 80% (или, что удобнее, 0,8), значит, по уравнению,
0,8 Х молей или 32*0,8Х = 25,6Х г образовалось метанола
0,8Х молей прореагировало угарного газа
Х - 0,8Х = 0,2Х молей или 28*02Х = 5,6 Х г осталось СО в смеси
0,8Х * 2 = 1,6Х водорода вступило в реакцию
(1-Х) - 1,6Х = (1 - 2,6Х) молей или 2*(1 - 2,6Х) = (2 - 5,2Х) г Н₂ осталось
0,2Х + 0,8Х + 1 - 2,6Х = (1 - 1,6Х) молей всего в смеси после реакции
(5,6Х + 25,6Х + (2 - 5,2Х))/(1 - 1,6Х) молярная масса смеси после реакции
(5,6Х + 25,6Х + (2 - 5,2Х))/(1 - 1,6Х) > 2,6 * 4 по условию
31,2Х -5,2Х + 2 > 10,4 * (1 - 1,6Х)
26Х + 16,64Х > 10,4 - 2
42,64Х > 8,4 ⇒
Х > 8,4/42,64 ; Х > ~ 0,197 ( значение округлено) уточненная доля СО в смеси
1 - Х < 1 - 0,197 ; 1 - Х < 0,803 (примерно)
3). Определение максимальной доли водорода в %
0,803 = 0,8943*100% = 80,3%
Т.о, максимальная мольная доля водорода в смеси не превышает 80 %. Поскольку в задании подчеркнуто, что все вещества - газы, то мольные доли равны объемным.
ответ: 80 %