1) В главных подгруппах в основном те металлы, которые имеют постоянную степень окисления(s и p элементы) , у остальных уже появляется d и f уровни, из-за которых наблюдаются переменные степени окисления
2) Потому что у них появляются проскоки электронов, d или f подуровень
3) Потому что они имеют высшую степень окисления и повышать им некуда. Следовательно, они могут быть окислителями(понижать степень окисления)
4) Окисление это принятие электронов( понижение степени окисления)
Восстановление - отдача электронов(повышение степени окисления)
5) Качественными называются те реакции, в которых можно увидеть какие-либо опознавательные признаки соединения в реакции(газ, осадок изменение окраса раствора и тд)
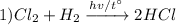
Реакция взаимодействия газообразных хлора и водорода на свету или при нагревании, с получением хлороводорода, реакция соединения
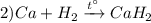
Реакция взаимодействия металлического кальция с парами водорода при нагревании, с образованием гидрида кальция, реакция соединения
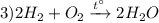
Реакция взаимодействия водорода с кислородом, с образованием воды, стехиометрическое количество смеси называется гремучий газ, реагирует с мгновенным взрывом и большим выделением тепла, реакция соединения
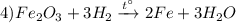
Взаимодействие оксида железа (III) с водородом при нагревании, с образованием железа и воды, возможен вариант взаимодействия с углем, алюминием или угарным газом, реакция замещения
Дано:
m(раствора NaOH)=100г.
ω%(NaOH)=4%
m(Na₂CO₃)-?
1. Определим массу чмстого гидроксида натрия в растворе:
ω%=m(вещества)÷m(раствора NaOH)×100%
m(NaOH)=ω%(NaOH)×m(раствора NaOH)÷100%
m(NaOH)=4%×100г÷100%=4г.
2. Определим молярную массу гидроксида натрия и его количество вещества в 4г.:
M(NaOH)=23+16+1=40г./моль
n(NaOH)=m(NaOH)÷M(NaOH)
n(NaOH)=4г.÷40г./моль=0,1моль
3. 2NaOH + CO₂ = Na₂CO₃ + H₂O
n(NaOH)=2моль n(Na₂CO₃)=1моль
n₁(NaOH)=0,1моль n₁(Na₂CO₃)=0,05моль
4. Определим молярную массу карбоната натрия и его массу количеством вещества в 0,05моль:
M(Na₂CO₃)=23x2+12+16x3=106г./моль
m(Na₂CO₃)= n₁(Na₂CO₃)х M(Na₂CO₃)
m(Na₂CO₃)=0,05моьх106г./моль=5,3г.
5. ответ: из раствор NaOH массой 100г с массовой долей 4% при пропускании CO₂ образовалось 5,3г. карбоната натрия.