Уравнение реакции:
Zn (M = 65 г/моль) + H2SO4 (M = 98 г/моль) = ZnSO4 (M = 161 г/моль) + H2 (M = 2 г/моль);
Пусть масса полученного р-ра = 100 г., тогда масса ZnSO4 = 10 г., что составляет 10/161 = 0.0621 моль;
помимо ZnSO4, образовался H2 массой 2×0.0621 = 0.1242 г;
в реакцию вступили цинк массой 65×0.0621 = 4.0365 г. и H2SO4 массой 98×0.0621 = 6.0858 г.;
масса полученного р-ра = (масса исх. р-ра H2SO4+масса цинка)-масса H2 = 100 г., тогда масса исх. р-ра = (100+0.1242)-4.0365 = 96.0877 г.;
w H2SO4 в исх. р-ре = 6.0858/96.0877 ≈ 0.06334 или 6.334%;
ответ: 6.3.
1)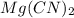 ⇒
⇒ 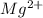 + 2
+ 2 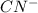
Гидролиз протекает и по катиону и по аниону, т.к соль образована слабым основанием и слабой кислотой.
Протолитическая форма:
Гидролиз по катиону:
Краткое ионное уравнение:
1 ступень: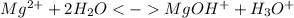
2 ступень:
Гидролиз по аниону:
Молекулярное ур-е: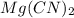 + 2
+ 2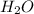 ⇔
⇔ 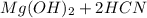 , среда слабощелочная, т.к константа диссоциации основания Mg(OH)2 > константы диссоциации кислоты HCN.
, среда слабощелочная, т.к константа диссоциации основания Mg(OH)2 > константы диссоциации кислоты HCN.
2) Rb₂SO₃ ⇒ 2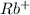 +
+ 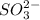
Соль образована сильным основанием и слабой кислотой, гидролиз идет по аниону.
Краткое ионное уравнение гидролиза:
Гидролиз по аниону:
Молекулярное ур-е: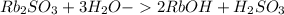
Среда щелочная, т.к в итоге выделились гидроксид ионы, pH>7. Также степень диссоциации основания > степени диссоциации кислоты, из чего можно сделать вывод, что среда - кислая.
3)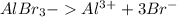
Соль образована слабым основанием и сильной кислотой, поэтому гидролиз идет по катиону.
Протолитическая форма:
Молекулярное ур-е: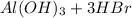
Сокращенное ионное уравнение:
1 ступень: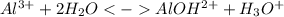
2 ступень: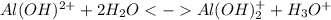
3 ступень: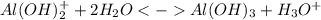
Среда кислая из-за образования ионов гидроксония. Также константа диссоциации основания < степени диссоциации кислоты, это также подтверждает, что среда кислая.
4)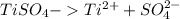
Соль образована слабым основанием и сильной кислотой, гидролиз протекает по катиону:
Протолитическая форма:
Молекулярное ур-е: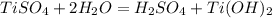
Сокращенное ионное уравнение:
1 стадия: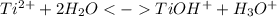
2 стадия: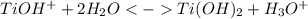
Среда кислая из-за присутствия ионов гидроксония. Также степень диссоциации основания < степени диссоциации кислоты, следовательно среда будет кислая, pH<7.