
Пошаговое объяснение:
Сокращаем
21/22×22/23= 21/23
21/23×23/24=21/24
22/24×24/25=22/25
22/25×25/26=22/26
22/26×26/27=22/27
22/27×27/28=22/28
22/28×28/29=22/29
22/29×29/30=22/30
22/30×30/31=22/31
Чтобы привести дроби к общ. знаменателю, найдем НОЗ. Для этого разложим числа в знаменателях на множители. Возьмём множители большего числа и умножим на недостающие множители второго числа.
========================
Например,
4 = 2 * 2
12 = 3 * 2 * 2
А т.к. в множителях числа 12 есть и множители числа 4, то просто перемножим множители 12 и получим НОЗ.
3 * 2 * 2 = 12 - НОЗ
Приведем к общ. знаменателю
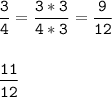
У дробей с одинаковыми знаменателями сравниваются числители, соответственно если числитель больше, то и дробь больше, а если числитель меньше, то и дробь меньше.
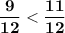 ⇔
⇔ 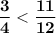
***************************************
Дальше.
5 - простое число, т.е. 5 = 1 * 5
15 = 3 * 5
Найдем НОЗ
3 * 5 = 15 - НОЗ
Приведем к общ. знаменателю
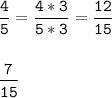
⇒ 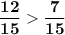 ⇔
⇔ 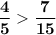
***************************************
6 = 2 * 3
24 = 2 * 2 * 2 * 3
Найдем НОЗ
2 * 2 * 2 * 3 = 24 - НОЗ
Приведем к общ. знаменателю
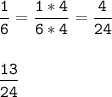
⇒ 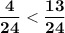 ⇔
⇔ 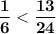
***************************************
7 - простое число, т.е. 7 = 1 * 7
56 = 2 * 2 * 2 * 7
Найдем НОЗ
2 * 2 * 2 * 7 = 56 - НОЗ
Приведем к общ. знаменателю
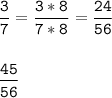
⇒ 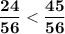 ⇔
⇔ 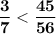
Легкий мягкий пластичный металл серебристо-белого цвета. Имеет три структурные модификации, переходит из состояния α-олово (серое олово) в β-олово (белое олово) при температуре +13,2 °С, а в состояние γ-олово при t +161 °С. Модификации весьма сильно отличаются своими свойствами. α-олово — серый порошок, который относят к полупроводникам, β-олово («обычное олово» при комнатной температуре) — серебристый ковкий металл, γ-олово — белый хрупкий металл.
В химических реакциях олово проявляет полиморфизм, то есть кислотные и оснóвные свойства. Реактив достаточно инертный на воздухе и в воде, так как быстро покрывается прочной оксидной пленкой, защищающей его от коррозии.
Олово легко вступает в реакции с неметаллами, с трудом — с концентрированной серной и соляной кислотой; с этими кислотами в разбавленном состоянии не взаимодействует. С концентрированной и разбавленной азотной кислотой реагирует, но по-разному. В одном случае получается оловянная кислота, в другом — нитрат олова. Со щелочами вступает в реакции только при нагревании. С кислородом образует два оксида, со степенью окисления 2 и 4. Является основой целого класса оловоорганических соединений.
Олово используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами. Главные промышленные применения олова — в белой жести (лужёное железо) для изготовления тары пищевых продуктов, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов.
21/31 будет уверен 1000000% процентов