Задача №1
- Уравнение:
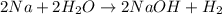
- вычислим количество вещества водорода:
n = V/Vm = 4,48л/22,4л/моль = 0,2 моль
- По уравнению реакции:
n(Na) = 2n(H2) = 0.2моль*2 = 0,4 моль
- Вычисляем массу натрия:
m(Na) = n*M = 0,4моль*23г/моль = 9,2 грамма
Отвеот: масса натрия равна 9,2 грамма
Задача №2
- Уравнение:
CuO + H2 = Cu + H2O
-По уравнению реакции, видим, что:
n(H2) = n(CuO) = 1,5 моль
- Масса 1,5 моль водорода:
m= n*M = 2г/моль*1,5моль = 3 грамма
- По уравнению реакции, видим, что:
n(Cu) = n(CuO) = 1.5 моль
- Рассчитывеам массу 1,5 моль меди:
m = n*M = 1,5 моль*64г/моль = 96 грамм
Формулой является CaO. Докажем, проведя рассчеты. w - массовая доля, n - число атомов, Ar и Mr - атомная и молекулярные массы.
Сначала найдем молекулярную массу оксида кальция.
Mr(CaO)= Ar(Ca) + Ar(O) = 40 + 16 = 56
Рассчитаем массовые доли элементов в соединении:
w(Ca) = n x Ar / Mr = 1 x 40 / 56 = 0,73 = 73%
w(O) = n x Ar / Mr = 16 / 56 = 0,28 = 28%
Получившиеся у нас в итоге числа полностью совпадают, значит мы не ошиблись.