Уравнение реации:
N2 + 3H2 = 2NH3
Константа равновесия, выраженная через молярные концетрации(размерности опущены):
![Kc = \frac{[NH3]^2}{[N2]*[H2]^3}](/tpl/images/0976/4973/2bbb4.png)
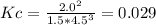
Так как концентрация аммиака в исходной смеси равна нулю, то его равновесная концентрация равна концентрации образовавшегося в ходе реакции аммиака. На образование аммиака были израсходованы некоторые концентрации водорода и азота. Найдём их при стехиометрических соотношений:
c(H2)_расход = 3/2 * 2.0 = 3.0 моль/л.
c(N2)_расход = 1/2 * 2.0 = 1.0 моль/л.
Начальные концентрации исходных веществ равны сумме концентраций израсходованных в результате химической реакции и равновесных веществ:
c(H2)_начальная = 1.5 + 1.0 = 2.5 моль/л.
с(N2)_начальная = 4.5 + 3.0 = 7.5 моль/л.
но давайте за это побольше