Відповідь:
Дано:
Е2О5
Mr(E2O5)= 142
Знайти:
Е - ?
Розв’язок:
Ar(E)=(Mr(E2O5) – n * Ar(O)) : 2= 62 : 2 = 31
Це Р. Він знаходиться у V групі третього періоду періодичної системи хімічних елементів; неметал; Сусідом Фосфору за підгрупою є Нітроген. Сусідами Фосфору за періодом є Силіцій та Сульфур. Неметалічні властивості атомів хімічних елементів головних підгруп зі зростанням порядкового номера зростають у періодах і знижуються у групах. Тому неметалічні властивості Фосфору більш виражені, ніж у Силіцію та менш виражені, ніж у Нітрогену та Сульфуру.
Будова атома:
1) заряд ядра атома - 15
2) відносна атомна маса хімічного елемента - 31
3) число протонів - 15
4) число електронів - 15
5) число нейтронів 16
6) число електронних рівнів в атомі - 3
1.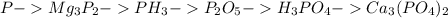
1)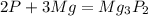
2)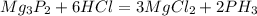
3)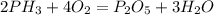
4)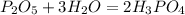
5)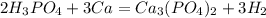
2.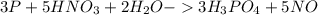
окисление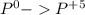 (-5e) восстановитель |5|3
(-5e) восстановитель |5|3
восстановление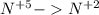 (+3e) окислитель |3|5
(+3e) окислитель |3|5
3. Дано:
m(P)=31кг
________________________________
m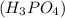 =?
=?
0,2 x
3кмоль 3кмоль
mчист.(P)=31кг*0,2=6,2кг
n(P)=6,2кг/31кг/кмоль=0,2кмоль
m(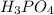 )=0,2кмоль*98кг/кмоль=19,6кг
)=0,2кмоль*98кг/кмоль=19,6кг
m(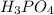 )=19,6кг*08=15,68 кг
)=19,6кг*08=15,68 кг
ответ: 15,68кг