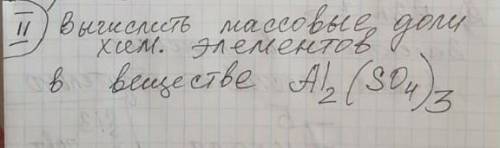
Вычислим М(в-ва)
М = 27*2+ 32*3+16*4*3 = 342
W=n*Ar(эл)\M(в-ва)
W(Al)= 2*27\342=0,16= 16%
W(S)= 3*32\342=0,28=28%
W(O)= 12*16\342=0,56=56%
ответ:Комплексные щелочные цианидные электролиты отличаются простотой состава, наибольшей среди электролитов меднения рассеивающей и кроющей в них формируются мелкокристаллические, малопористые осадки.
Основой таких электролитов является комплексная цианистая соль меди и цианид калия или натрия. Другие компоненты вводят с целью повышения стабильности растворов и увеличения рабочего диапазона плотностей тока.
Медь находится в растворе в одновалентной форме и в присутствии даже небольшого количества свободного цианида образует соединение типа Na2[Cu(CN)3] или K2[Cu(CN)3]. Основным комплексным ионом, разряжающимся на катоде, является [Cu(CN)2]2-
[Cu(CN)2]2- + 2 → Cu + 2CN-. (12.г)
Процесс цианидного меднения идет с высокой катодной поляризацией, которая объясняется диффузионными ограничениями (концентрационное перенапряжение) и затруднениями разряда ионов. Катодное перенапряжение возрастает с повышением концентрации свободного цианида и уменьшением содержания меди в растворе. Это обстоятельство благоприятно сказывается на рассеивающей электролита, но одновременно приводит к снижению выхода металла по току и допустимой плотности тока. Как видно из рис. 12.1 для всех исследованных растворов наблюдается понижение выхода металла по току с увеличением плотности тока и в тем большей степени, чем меньше концентрация ионов меди и выше содержание свободного цианида. Эта закономерность повышению равномерности толщины покрытий на поверхности катода.
Объяснение:
M(Al₂(SO₄)₃)=2·27+3·32+12·16=342 г/моль (с таблицы Менделеева)
n - количество атомов в вещ-ве
w(Al)=M(Al)·n/M(Al₂(SO₄)₃)·100%=27·2/342·100%=15,79%
w(S)=M(S)·n/M(Al₂(SO₄)₃)·100%=32·3/342·100%=28,07%
w(O)=M(O)·n/M(Al₂(SO₄)₃)·100%=16·12/342·100%=56,14%
ответ : 15,79%, 28,07%, 56,14%