1) а) 1. 2Mg + O₂ -> 2MgO
2. MgO + CO₂ -> MgCO₃
3. MgCO₃ + 2NaOH -> Mg(OH)₂ + Na₂CO₃
4. Mg(OH)₂ -> MgO + H₂O
5. MgO + C -> CO + Mg
б) 1. 2N₂ + 5O₂ -> 2N₂O₅
2. N₂O₅ + H₂O -> 2HNO₃
3.8 HNO₃ + 3Mg -> 3Mg(NO₃)₂ + 4H₂O + 2NO
2) Дано:
m(HNO₃) = 126г
Найти:
V(N₂O₅) - ?
Записываем уравнение реакции:
N₂O₅ + H₂O -> 2HNO₃
Находим количество вещества азотной кислоты:
M(HNO₃) = 1 + 14 + 3 × 16 = 63г/моль
n(HNO₃) = 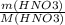 =
= 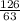 = 2 моль
= 2 моль
Находим количество вещества оксида азота:
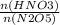 =
= 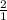 => n(N₂O₅) =
=> n(N₂O₅) = 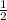 n(HNO₃) = 2 × 0,5 = 1 моль
n(HNO₃) = 2 × 0,5 = 1 моль
Находим Объём оксида азота:
V(N₂O₅) = n(N₂O₅) × Vm = 1 моль × 22,4 л/моль = 22,4 л
ответ: 22,4 л
Объяснение:
Известь кипелка - это СаО - негашёная известь!
1) Так как в известняке 6,7% примесей, то чистого известняка
(100 - 6,7) = 93,3%
А по массе это будет:
m(CaCO₃) = (22*93,3)/100 = 20,526 т = 20526 кг
2) Уравнение обжига известняка:
СаСО₃ → СаО + СО₂↑
3) Находим молярные массы:
М(СаО) = 40 + 16 = 56 г/моль = 0,056 кг/моль
М(СаСО₃) = 10 + 12 + 3*16 = 100 г/моль = 0,1 кг/моль
4) По уравнению реакции составляем пропорцию:
0,1 кг СаСО₃ 0,056 кг СаО
20526 кг СаСО₃ Х кг СаО
Х = 20526*0,056/0,1 = 11494,56 кг
ответ: 11494,56 кг СаО