В домашнем быту мы используем:
Н2О – вода -умываемся, питьем, варим пищу, моем, стираем, делаем влажную уборку в доме, принимаем ванну.
NaCl - поваренная соль - добавляется в пищу для придания ей вкуса.
NaHCO3 - пищевая сода - добавляется в тесто, используется как моющее средство.
Na2CO3 - кальцинированная сода - используется как моющее средство.
СН3СООН - уксусная кислота - консервирующее средство для домашних заготовок, специя для салатов.
СН3СH2ОН - этиловый спирт - дезинфицирующее средство, так же слабый, официально разрешенный наркотик - можно употреблять для поднятия настроения.
Сахар - для изготовления кондитерских изделий, для чая.
Na2SiO3 - силикатный или канцелярский клей - клеит бумагу и стекло.
W - вольфрам - материал нитей в лампочках накаливания.
Fe - железо - из него делают молоток, гвозди и еще много разных полезных предметов.
Al - алюминий - ложки и кастрюли.
NaOH - гидроксид натрия - первое средство, если засорилась канализационная труба.
Полистирол - на основе его композиции сделан, например, корпус телевизора.
Полиэтилен - из него делают множество упаковочных материалов.
Поливинилхлорид - распространенный изоляционный материал для проводов.
Целлюлоза - из нее делают книги, в деревне топят печь.
СН4 - метан - основной компонент природного газа, используется для отопления помещений и приготовления пищи.
Si - камень в зажигалках
Глютамат натрия - главная составляющая большинства вкусовых приправ.
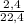 = 0,107 моль
= 0,107 моль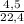 = 0,2 моль
= 0,2 моль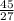 ≈ 1,7 моль
≈ 1,7 моль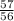 = 1,017 моль
= 1,017 моль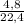 = 0,2 моль
= 0,2 моль
Дано:
m (N₂) = 42 г;
m (NH₃) = 51 г.
Найти:
m (H₂) — ?
Эту задачу можно решить в одно действие, применив закон сохранения массы. 51 г - 42 г = 9 г.
Но сейчас мы распишем по действиям и таким образом сделаем проверку закона сохранения массы.
1. Составим уравнение реакции.
3H₂ + N₂ = 2NH₃.
2. Узнаем количество вещества азота и аммиака. По формуле:
‣ n = m ÷ M; где: n - количество вещества (моль), m - масса (г), M - молярная масса (г/моль).
n (N₂) = 42 г ÷ 28 г/моль = 1,5 (моль). - недостаток.
n (NH₃) = 51 г ÷ 17 г/моль = 3 (моль). - избыток.
3. Мы видим, что азот в недостатке. Считаем всегда по недостатку.
Продолжаем вычисления дальше. По уравнению реакции мы видим, что азот и водород находятся в соотношении 3 к 1. Значит:
n (H₂) = 3n (N₂) = 3 · 1,5 моль = 4,5 (моль) - водорода.
4. Теперь узнаем массу водорода. По формуле:
‣ m = n · M; где: m - масса (г), n - количество вещества (моль), M - молярная масса (г/моль).
m (H₂) = 4,5 моль · 2 г/моль = 9 (г).
Как видим, всё сошлось. Закон сохранения массы работает.
ответ: 9 г.