Объяснение:
Вычислить ЭДС гальванического элемента Mn/Mn2+ (0,05 моль/л) // Fe2+ (0,05 моль/л)/Fe
Пластинка из более активного металла ( в нашем случае это марганец является анодом и на марганцевой пластине протекает процесс: Mn - 2e = Mn2+. Железная пластина является катодом и на катоде протекает процесс: Fe2+ + 2e = Fe. При соединении проводником анода и катода потечет ток.
Токообразующая реакция Mn(0) + Fe2+ = Mn2+ + Fe(0)
Стандартный электродный потенциал марганцевого электрода
Е° Mn2+/Mn = - 1, 185 B
Реальный потенциал марганцевого электрода может быть рассчитан по формуле:
0,0591
E(Mn2+/Mn) = E°(Mn2+/Mn) + × lg [Mn2+] =
2
0,0591
-1,185+ × lg 0,05 = - 1,223 B
2
Стандартный электродный потенциал железного электрода
Е° Fe2+/Fe = - 0, 447 B
Реальный потенциал железного электрода может быть рассчитан по формуле:
0,0591
E (Fe2+/Fe) = E° (Fe2+/Fe) + × lg [Fe2+] =
2
0,0591
-0,447 + × lg 0,05 = - 0,485 B
2
Для вычисления ЭДС гальванического элемента нужно из потенциала катода вычесть потенциал анода:
- 0,485 В - (- 1,223 В) = 0,738 В.
Дано:
m(MgCO3) = 40 г
m(р-ну HCl) = 36,5 г
W(HCl) = 15% або 0.15
Знайти: V(CO2)-?
Розв'язання:
1)Знайдемо масу HCl у розчині:
m(HCl) = W(HCl)*m(р-ну HCl) = 0.15 * 36.5 г = 5.475 г
2)Запишемо рівняння реакції і знайдемо кількості речовин реагентів (MgCO3 і HCl)
40 г 5.475 г х л
MgCO3 + 2HCl =MgCl2 + H2O + CO2↑
84 г 2*36.5= 22.4 л
73 г
n(MgCO3) = 40/84=0.48 моль
n(HCl) = 5.475/73 = 0.075 моль
Бачимо, що магній карбонат взяли у надлишку, тому розрахунки будемо проводити по HCl:
V(CO2)=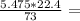 1.68 л
1.68 л
Відповідь: 1.68 л СО2