6.8
Объяснение:
Запишем уравнение реакции
Cu + 2AgNO₃ = 2Ag + Cu(NO₃)₂
Пусть в реакцию вступило х моль меди, тогда по уравнению образовалось 2х моль серебра. Найдём массы ушедшей в раствор меди и осевшего на пластинке серебра
m(Cu)=M*n=64x г
m(Ag)=M*n=108*2x=216x г
Если медь ушла в раствор, то поставим перед её массой -, а если серебро пришло, то +, начальная и конечная массы пластинок нам даны
10-64х+216х=17,6
152х=7,6
х=0,05 моль
Тогда нитрата серебра вступило в реакцию по уравнению
2*0,05=0,1 моль
Его масса
Δm(AgNO₃)=M*n=170*0,1=17 г
Масса исходного раствора
mp(AgNO₃)=ρ*V=1,25*160=200 г
Масса нитрата серебра в нём
m₀(AgNO₃)=mp*ω=200*0,119=23,8 г
После реакции осталось нитрата серебра в растворе
m'(AgNO₃)=m₀=Δm=23,8-17=6,8 г
, решение Вашей цепочки превращений.
Видимо, в условии ошибка, не понимаю зачем уравнивать электронным балансом третье уравнение (там всё уравнялось само собой)
Объяснение:
1 уравнение слева направо:
Карбонат магния, хлороводородная (соляная) кислота, хлорид магния, оксид углерода (IV) (углекислый газ), вода;
2 уравнение:
Хлорид магния, магний, хлор;
3 уравнение:
Магний, сера, сульфид магния;
4 уравнение:
Сульфид магния, кислород, сульфат магния;
5 уравнение:
Сульфат магния, азотная кислота, нитрат магния, серная кислота.
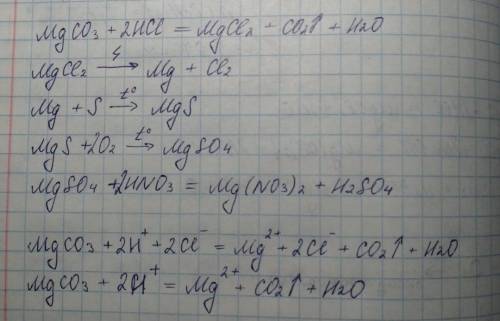
Объяснение:
2Zn + O2 = 2ZnO
ZnO + 2HCl = ZnCl2 + H2O
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Na2[Zn(OH)4] + 2HCl =2 NaCl + Zn(OH)2 + 2H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O