Ковалентная связь (от лат. co — «совместно» и vales — «имеющий силу») — химическая связь, образованная перекрытием (обобществлением) пары валентных (находящихся на внешней оболочке атома) электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Ковалентная связь включает в себя многие виды взаимодействий, включая σ-связь, π-связь, металлическую связь, банановую связь и двухэлектронную трёхцентровую связь.
Коваленттік байланыс (латын тілінен аударғанда - «бірге» және vales - «күш») - бұл бұлт (жұп) атомның сыртқы қабатында (атомның сыртқы қабатында орналасқан) электронды бұлттардың қабаттасуы (әлеуметтену) нәтижесінде пайда болатын химиялық байланыс. Қосылатын электрондық бұлттар (электрондар) жалпы электронды жұп деп аталады.
Коваленттік байланыс өзара әрекеттесудің көптеген түрлерін қамтиды, соның ішінде σ-байланыс, π-байланыс, металл байланысы, банан байланысы және екі электронды үш центрлік байланыс.
m=1665 г.
Прежде всего необходимо рассмотреть уравнение реакции:
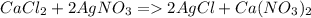
Осадком в данной реакции является AgCl - белый творожистый. Как видно из уравнения реакции для образования двух молекул AgCl нужна одна молекула исходного вещества, поэтому можно сделать вывод, что при условии избытка нитрата серебра (который подразумевается), требуется 0,15 моль хлорида кальция, а значит масса самого вещества составляет 0,15*(40+35,5*2)=16,65 г. (Масса = количество вещества * молярную массу). Но, поскольку раствор состоит лишь на 0,01 (или 1%) из хлорида кальция, то масса всего раствора m=16,65/0,01=1665 г.
НСООН + NaOH = HCOONa + H₂O
1) Найдем массу чистой (безводной) щелочи:
ω=m(вещества)/m(раствора)×100% ⇒ m(вещества) = ω×m(раствора)÷100%
m(вещества) = 40%×200÷100% = 80 г NaOH
2) Расчет по уравнению реакции:
Молярные массы:
М (NaOH) = 40 г/моль
М (HCOONa) = 68 г/моль
40 г NaOH дают 68 г HCOONa
80 г NaOH дают х г HCOONa
х= 80×68÷40 = 136 г HCOONa
ответ: масса образующейся соли равна 136 г.