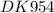ответ: Формула алкана :С3Н8 пропан
Объяснение:Находим среднюю молярную массы газовой смеси дои после реакции: М1=1,4884*22,4=33,34(до реакции) М2=1,6964*22,4=38(после реакции).Допустим объем газовой смеси после реакции 100 литров,тогда 44х+32(100-х)=3800,оттуда х=50 литров,это объем углекислого газа и 100-х= 50 литров объем кислорода,который остается в избытке после реакции.
Напишем уравнению сгорание алкана
СnH2n+2+0,5(3n+1)O2>nCO2+(n+1)H2O. Найдем начальные объемы алкана и кислорода
алкана 50/n,кислорода (25(3n+1))/n+50
Для начальной газовой смеси можно написать следующее уравнению
(50(14n+2))/n+32(50+(25(3n+1))/n=33,34(50/n+50+(25(3n+1))/n)*32
Упрастив получим (4700n+900)=33,34(125n+75)
Оттуда n=3
1) Для начал мы запишем уравнение реакций из условия задачи:
Al₂O₃(т.) + 3SO₂(г.) → Al₂(SO₄)₃(т.)
2) Далее мы напишем уравнение для нахождения энтальпий в этой уравнений реакций:
ΔH = ∑Hпр.реак. - ∑Hисх.в-в. = ΔH°₂₉₈(Al₂(SO₄)₃) - (ΔH°₂₉₈(Al₂O₃) + 3ΔH°₂₉₈(SO₂)) = -3444 кДж/моль - (-1676 кДж/моль + 3×(-395,2 кДж/моль)) = -3444 кДж/моль - (-1676 кДж/моль - 1185,6 кДж/моль) = -3444 кДж/моль - (-2861,6 кДж/моль) = -3444 кДж/моль + 2861,6 кДж/моль = -582,4 кДж/моль
3) Теперь находим энтропии в этой уравнений реакций:
ΔS = ∑Sпр.реак. - ∑Sисх.в-в. = ΔS°₂₉₈(Al₂(SO₄)₃) - (ΔS°₂₉₈(Al₂O₃) + 3ΔS°₂₉₈(SO₂)) = 239 Дж/(моль×К) - (-50,9 Дж/(моль×К) + 3×256,23 Дж/(моль×К)) = 239 Дж/(моль×К) - (-50,9 Дж/(моль×К) + 768,69 Дж/(моль×К)) = 239 Дж/(моль×К) - 717,79 Дж/(моль×К) = -478,79 Дж/(моль×К)
ответ: ΔH = -582,4 кДж/моль ΔS = -478,79 Дж/(моль×К)
Решено от :