Для этого достаточно добавить в каждую пробирку с веществами один реактив - серную кислоту:
Если в одной из пробирок увидите вскипание массы и услышите шипение,что свидетельствует о выделении газа,то в это раствор карбоната,потому что в результате образуется не стойкая угольная кислота,которая тут же разлагается на воду и углекислый газ(отсюда и шипение,и вскипание массы):
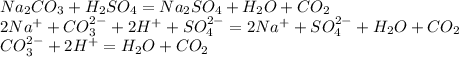
Если выпадет в какой либо иной пробирке студенистый осадок,то это раствор силиката натрия,потому что образуется нерастворимая кремниевая кислота,которая и выпадает в осадок:
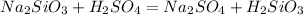 - осадок
- осадок
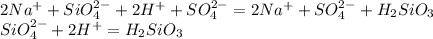
А в третьей пробирке никаких визуальных изменений не произойдет,значит это остался сульфат натрия
18,3 г 7,5 г
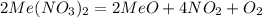
(2х+ 248) г (2х+32) г
Если принять атомную массу метала в составе нитрата за Х,то получим такую пропорцию:
при взаимодействии (2х+248) г нитрата получится (2х+32) г оксида, а
при -- // -- 18,3 г____________________7,5 г, откуда,решив данную пропорцию(перемножив наискось,по диагонали данные), получим обычное алгебраичное уравнение:
18,3*(2х+32)=7,5*(2х+248)
36,6х+ 585,6=15х+1860
36,6х-15х=1860-585,6
21,6х= 1274,4
х= 59
Воспользовавшись периодической системой и найдя металл с относительной атомной массой 59,обнаружим,что это либо Кобальт,либо Никель.Значит формулы солей:
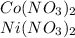
1) Заряд ядра
2) Число электронов на внешнем энергетическом уровне
3) Восстановительные свойства
4) Основные свойства
5) Окислительные свойства
6) Кислотные свойства соединений
7) Радиус атома
8) Степень окисления
9) Характерная валентность
10) Электроотрицательность
11) Легкость отрыва электрона