1)Mg
потому что порядковый номер магния 12
порядковый номер равен количеству электронов в атоме
на первом энергетическом уровне 2 электрона
на втором 8 на третьем остальные 2
это выглядит так:
12Mg) ) ) 1S2 2S2 2P6 3S2
2 8 2
в данном случае внешним уровнем является 3-й уровень
Объяснение:
1. Составьте в молекулярном и ионном виде уравнения возможных реакций взаимодействия соляной кислоты со следующими веществами: оксидом натрия, гидроксидом кальция, кальцием, серебром, нитратом кальция. Обоснуйте ответ.
2НСl + Na2O(тв) = 2NaCl + H2O молекулярное
2Н(+) + 2Сl(-) + Na2O(тв) = 2Na(+) + 2Cl(-) + H2O ионное
2Н(+) + Na2O(тв) = 2Na(+) + H2O ионное сокращенное
2НСl + Са(ОН)2 = СaCl2 + 2 H2O молекулярное
2Н(+) + 2Сl(-) + Са(2+) + 2ОН(-) = Сa (2+) + 2Cl(-) + 2 H2O ионное
2Н(+) + 2ОН(-) = 2H2O ионное сокращенное
Примечание! гидроксид кальция взят в виде известковой воды
2НСl + Ca = СaCl2 + H2↑ молекулярное
2Н(+) + 2Сl(-) + Са(мет) = Сa (2+) + 2Cl(-) + H2↑ ионное
2Н(+) + Са(мет) = Сa (2+) + H2↑ ионное сокращенное
2НСl + Ag ---/> реакция не идет поскольку серебро расположено в ряду напряжений за водородом и не вытеснить водород из кислоты-неокислителя.
2Н(+) + 2Сl (-) + Ca(2+) + 2NO3(-) ---/---> реакция обратима и не идет до конца, поскольку все исходные ионы остаются в растворе.
2. Напишите уравнение реакций, при которых можно осуществить следующие превращения:
Азот → оксид азота (V) → азотная кислота → нитрат алюминия
N2 + O2 = 2NO↑ 2NO + O2 = 2NO2↑
4NO2 + 2H2O + O2 = 4HNO3
8Al + 30HNO3 =8 Al(NO3)3 + 3 N2O↑ + 15 H2O
3. Закончите молекулярные уравнения реакций и запишите соответствующие им полные и сокращенные ионные уравнения:
BaCl2 + 2AgNO3 = Ba(NO3)2 + 2AgCl↓
Ba (2+) + 2Cl(-) + 2Ag(+) + 2 NO3(-) → Ba (2+) + 2NO3(-) + 2AgCl↓
Cl(-) + Ag(+) = AgCl↓
2NaOH + H2SO4 = Na2SO4 + 2H2O
2Na(+) + 2OH(-) + 2H(+) + SO4(2-) = 2Na(+) + SO4(2-) + 2H2O
H+ + OH - = H2O
4. Вычислите массу осадка, образовавшегося при взаимодействии 4 г сульфата меди (II) с гидроксидом калия.
Запишем уравнение реакции
4 г
CuSO4 + 2 KOH = Cu(OH)2↓ + K2SO4
По условию задачи масса сульфата меди (II) вступившей в реакцию 4 г. Очевидно масса гидроксида калия достаточна для взаимодействия с сульфатом меди
M(CuSO4) = 160 г/моль. n(CuSO4) = 4 г : 160 г /моль = 0,025 моль.
По уравнению реакции n(CuSO4) = n Cu(OH)2
Молярная масса Cu(OH)2 равна 98 г/моль.
Тогда масса осадка гидроксида меди(II) составит 98 г/моль х
0,025 моль = 2,45 г
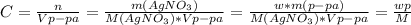
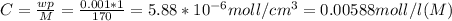
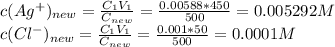
магний Mg c зарядом 0 имеет два электрона на внешнем слое