Химические свойства:
При химической реакции с металлами, галогены действуют, как окислители. Если, к примеру, взять фтор, то даже в обычных условиях он дает реакцию с большинством металлов. А вот алюминий и цинк воспламеняется даже в атмосфере: +2-1:ZnF2.
Физические свойства:
1. Такие химические вещества, как галогены, состоят из двух атомов;
2. Если рассматривать галогены в обычных условиях, то следует знать, что фтор и хлор, находятся в газообразном состоянии, тогда как бром является жидким веществом, а йод и астат относятся к твердым веществам.
3. У галогенов температура плавления, кипения и плотность повышаются с увеличением атомной массы. Также при этом и меняется их окраска, она становиться более темной.
4. При каждом увеличении порядкового номера, уменьшается химическая активность, электроотрицательность и более слабыми становятся неметаллические свойства.
5. Галогены обладают образовывать соединения между собой, как например BrCl.
6. Галогены при комнатной температуре могут находиться во всех трех состояниях материи.
7. Так же важно запомнить то, что галогены относятся к довольно таки токсичным химическим веществам.
Предложенное сокращённое ионное уравнение - 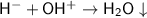 .
.
Ошибка №1. Заряд иона водорода должен быть равен 1+, а не 1-. То есть вместо H⁻ должно быть Н⁺ (именно катион водорода с гидроксид-ионом образует молекулу воды).
Ошибка №2. Заряд гидроксид-иона должен быть равен 1-, а не 1+. То есть вместо ОН⁺ должно быть ОН⁻ (степень окисления кислорода равна -2, а степень окисления водорода равна +1 ⇒ тогда общий заряд гидроксид-иона равен : -2 + 1 = 1-).
Ошибка №3. После молекулы воды стрелку вниз ( ) ставить не нужно, так как вода является слабым электролитом, но не осадком.
) ставить не нужно, так как вода является слабым электролитом, но не осадком.
Верное сокращённое ионное уравнение -  .
.
1) n(УВ)=25÷22.4=1.1161моль
2) n(CO2)=75÷22.4=3.3482моль
3)n(H2O)= 100÷22.4=4.4643моль
составляем пропорцию:
1,1161/1=3,3482/х; 1,1161/1=4,4643/у/₂
1,1161х=3,3482; 1,1161/1=8,9286/у
х=2,99. 1,1161у=8,9286
у=7,99
Простейшая формула УВ(углеводорода) - С₃Н₈-пропан