грамм-молекулярная масса ca(no3)2*4h2o составляет 236 г. на долю ca(no3)2 приходится 164 г., на долю 4 молей воды – 72 г.
найдем количества молей ca(no3)2 и ca(no3)2*4h2o:
n(ca(no3)2) = n(ca(no3)2*4h2o) = 61,5/164 = 0,375 моль.
найдем массу 0,375 моль ca(no3)2*4h2o:
m(ca(no3)2*4h2o) = 0,375 *236 = 88,5 г.
масса «чистой» воды без учета кристаллизационной составляет: 111,5 — 88,5 = 23 г.
теперь найдем растворимость кристаллогидрата ca(no3)2*4h2o, для чего составим пропорцию:
23 г. воды растворяют 88,5 г. ca(no3)2*4h2o
100 г. » » х г. »
х = 100 ⃰ 88,5/23 = 384,7826 г.
ответ: 384,7826.
 моль
моль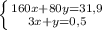
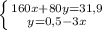

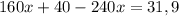

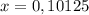 моль (это количество вещества Fe₂O₃)
моль (это количество вещества Fe₂O₃)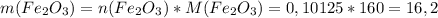 г
г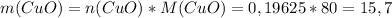 г
г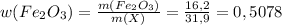 или 50,78% (где m(X) - это масса смеси)
или 50,78% (где m(X) - это масса смеси)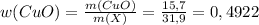 или 49,22%
или 49,22%
2)Расставьте коэффициенты методом ЭЛЕКТРОННОГО БАЛАНСА, укажите окислитель и восстановитель:
a) 4HNO3+C=4NO2↑ +CO2↑ + 2H2O
N+5+1e=N+4 4
C⁰-4e=C⁺⁴ 1
b) KNO3+Pb=KNO2+PbO
N⁺⁵+2e=N⁺³ 1
Pb⁰-2e=Pb⁺²1
c) 5HNO3+3P+2H2O=3H3PO4+5NO
N⁺⁵+3e=N⁺² 5
P⁰-5e=P⁺⁵ 3
d) HI+6HNO3= HIO3+6NO2↑ +3H2O
I⁻¹-6e=I⁺⁵ 1
N⁺⁵+1e=N⁺⁴ 6
e) 5KCIO3+6P=5KCI+3P2O5
Cl⁺⁵+6e=Cl⁻ 5
P⁰-5e=P⁺⁵ 6
f) 4Zn+5H2SO4=4ZnSO4+H2S+4H2O
Zn⁰-2e=Zn⁺² 4
S⁺⁶+8e=S⁻² 1