а) 2HNO3+Cu(OH)2→Cu(NO3)2+2H2O
2H(+)+2NO3(-)+Cu(OH)2→Cu(2+)+2NO3(-)+2H2O
2H(+)+Cu(OH)2→Cu(2+)+2H2O
б) SO2+2KOH→K2SO3+H2O
SO2+2K(+)+2OH(-)→2K(+)+SO3(2-)+H2O
SO2+2OH(-)→SO3(2-)+H2O
в) Реакция не произойдет, т.к. растворимая соль должна реагировать с щелочью, а Fe(OH)2 нерастворимое основание
г) NiCl2+Ba(OH)2→Ni(OH)2↓+BaCl2
Na(2+)+2Cl(-)+Ba(2+)+2OH(-)→Ni(OH)2↓+Ba(2+)+2Cl(-)
Na(2+)+2OH(-)+Ni(OH)2↓
д) 6NaOH+P2O5 → 2Na3PO4+3H2O
6Na(+)+6OH(-)+P2O5→6Na(+)+2PO4(3-)+3H2O
6OH(-)+P2O5→2PO4(3-)+3H2O
е) Реакция не произойдет, т.к. Cr(OH)2 нерастворимое основание.
Расписываем на ионы только растворимые вещества. Простые вещества, нерастворимые кислоты, соли, основания и оксиды не расписываем. В скобках написаны заряды ионов. Сокращаем одинаковые ионы в правой и левой части, получаем сокращенное ионное уравнение. Коэффиценты перед веществами нужно ставить так, чтобы в левой и правой части кол-во элементов было одинаковым.
Объяснение:
1. 3) C2 H6
4) CH3NO2
6) CH3COOH
2. брутто-формулами отражают состав, но не структуру молекул вещества и показывает точное количество атомов каждого элемента в одной молекуле
Для алкинов CnH2n-2, значит:
С3Н4 - пропин
С5Н8 - пентин
С8Н14 - октин
Для циклоалканов формула CnH2n, значит
С3Н6 циклопропан
С5Н10 циклопентан
С8Н16 циклооктан
3. Алканы соответствуют формуле CnH2n+2, алкены CnH2n:
1) C2 H6 алкан
2) C2 H4 алкен
4) C6 H14 алкан
6) C5 H10 алкен
3) C4 H6
5) C5 H8 это алкины
4. CH3—CH2—CH2—CH2—CH3 пентан
Н2С=СН2 этен
СH2 — CH2
| |
CH2 — CH2 циклобутан
Н2С=СН-СН=СН-СН2-СН3 гексадиен -1,3
CH3–C≡CH пропин
5-ый вопрос некорректно записан, если хотите результат, уточните
6. СН3 – СН2– СН2 – СН3 бутан
короткий гомолог СН3 – СН2 – СН3 пропан
длинный гомолог СН3 – СН2 – СН2 – СН2 – СН3 пентан
Реакция горения этилена:
C2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(г)
n =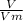 =
= 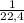 ≈ 0,045 моль
≈ 0,045 моль
ΔH = -59,06 кДж : 0,045 моль ≈ -1312,4 кДж/моль
ΔH = 2*ΔH°обр. (CO2) + 2*ΔH°обр. (H2O) - 1*ΔH°обр. (C2H4) - 3*0 - 1312,4 кДж/моль
примем ΔH°обр. (C2H4) за Х, тогда:
2*(-395,5) + 2*(-241,8) - Х
Х = -781 + (-483,5) + 1312,4
Х = 41,5 кДж/моль
ответ: 41,5 кДж/моль