Дано
CuSO₄ (р-р)
m(Cu) = 1,589 гр
Найти:
V(O₂) - ?
1) Для начала мы запишем уравнение электролиза раствора CuSO₄ вот так :
CuSO₄ → Cu²⁺ + SO₄²⁻
Kt⁻ : Cu²⁺ + 2e⁻ → Cu⁰ | 2 | | 2 |
H₂O | | 4 | |
An⁺ : SO₄²⁻ - не окисляется | | | |
2H₂O - 4e⁻ → O₂↑ + 4H⁺ | 4 | | 1 |
Следовательно получим уравнение реакций, протекающих на инертных электродах:
2Cu²⁺ + SO₄²⁻ + 2H₂O → Cu⁰ + O₂↑ + 4H⁺ + SO₄²⁻
2CuSO₄ + 2H₂O (электролиз) → 2Cu + O₂↑ + 2H₂SO₄
2) Далее находим количества вещества меди по уравнению реакций электролиза СuSO₄ , а потом у кислорода выделившееся на аноде:
М(Cu) = 64 гр/моль
n(Cu) = m(Cu)/M(Cu) = 1,589 гр / 64 гр/моль ≈ 0,0248 моль ≈ 0,025 моль ⇒ n(O₂) = 1/2 × m(Cu) = 1/2 × 0,025 моль = 0,0125 моль
3) Теперь находим объем кислорода выделившееся на аноде:
Vm = 22,4 л/моль
V(O₂) = n(O₂) × Vm = 0,0125 моль × 22,4 л/моль = 0,28 л
ответ: V(O₂) = 0,28 л
Решено от : 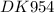
По значению плотности раствора в справочной литературе найдем массовую долю аммиака в процентах. Она равна 10%
Рассчитываем массу 1л раствора,
m(р-ра)=ρ∙V(р-ра)=0,958 г/мл ∙ 1000 мл= 958г
Рассчитываем массу растворенного аммиака в 958г раствора из формулы:
W%= m(в-ва)/ m(р-ра)∙100%
m(р-ра)= W%∙ m(в-ва)/ 100%
m(NH3)= 10%∙958г/100%=95,8г
Рассчитываем молярную концентрацию раствора аммиака:
С(NH3)=m(NH3)/M(NH3)∙Vр-ра=95,8г/17 г/моль∙1л=5.63 моль/л
Можно решить эту задачу используя формулу перехода от одних выраженных концентраций растворов к другим
С(х)= 10∙W(х)∙ρ/M(x), где:
W(х)- массовая доля вещества в растворе, в %;
ρ- плотность раствора, г/мл;
М(х)- молярная масса вещества;
С(х)- молярная концентрация вещества в растворе
С(NH3)=10∙10%∙0,956 г/мл /17 г/моль = 5,63 моль/л
Вычислите массовую долю аммиака в растворе, молярная концентрация которого 5,63 моль/л, ρ=0,958 г/мл. будет ли он являться нашатырным спиртом, который используется при первой при отравлении бензолом.
Рассчитываем массу 1л раствора,
m(р-ра)=ρ∙V(р-ра)=0,958 г/мл ∙ 1000 мл= 958г
Рассчитываем массу растворенного аммиака в 958г раствора из формулы:
W%= m(в-ва)/ m(р-ра)∙100%
m(р-ра)= W%∙ m(в-ва)/ 100%
m(NH3)= 10%∙958г/100%=95,8г
Рассчитываем массовую долю (%) NH3 в растворе
W%(NH3) =m(NH3)/m(р-ра)∙100%=95,7г/958 ∙100%=10%
Раствор аммиака с массовой долей 10% называется нашатырный спирт. Вдыхание воздуха с небольшой примесью аммиака возбуждающе действует, поэтому его используют для проведения человека в сознание при отравлении бензолом.