На нейтрализацию 0,944 г фосфористой кислоты H3PO3 израсходовано 1, 298 г гидроксида калия. Вычислите молярную массу эквивалента, фактор эквивалентности и основность кислоты. На основании проделанных вычислений составьте уравнение реакции.
n(H3PO3) = m/M =0,944 / 82 = 0,0115 моль
n(KOH) = m/M =1, 298 / 56 = 0,0232 моль
n(H3PO3) : n(KOH) = 0,0115 : 0,0232 = 1:2
Отсюда:
Фактор эквивалентности ƒэ (H3PO3) = ½, , так как одна формульная единица фосфористой кислоты обменивает с КОН два иона Н+.
Молярная масса эквивалента Мэ = М ∙ ƒэ = 82 / 2 = 41 г/моль
Основность = 2, т.к. только 2 ат. Н диссоциируют с образованием 2Н+, участв. в реакции нейтрализации.
Уравнение реакции: H3PO3 + 2КОН → К2HPO3 + 2Н2О
1 - соль сильной кислоты, сильного основания: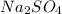 - сульфат натрия
- сульфат натрия
2 - соль слабого основания, сильной кислоты: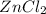 - хлорид цинка
- хлорид цинка
3 - соль слабой кислоты, сильного основания: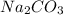 - карбонат натрия
- карбонат натрия
Нейтразлизация - по сути - гидролиз Сразу - первая соль не гидролизируется
Гидролиз хлорида ццинка пойдет по катиону: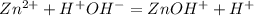
1 ступень:
2 ступень: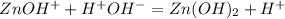
Гидролиз карбоната натрия пойдет по аниону: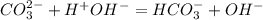
1 ступень:
2 ступень: HCO_3^- + H^+OH^- = H_2CO_3 + OH^-![</p <p[tex]NaHCO_3 + H_2O = NaOH + H_2CO_3](/tpl/images/0125/6763/a95ba.png)