а) n(NH3)=m(NH3) : M(NH3)=1.7г : 17г/моль= 0.1моль
V(NH3)=n(NH3)*Vm=0,1моль * 22.4дм3/моль= 2.24дм3
б) n(H2)=m(H2) : M(H2) = 1г : 2г/моль = 0.5 моль
V(H2)=n(H2)*Vm=0,5моль * 22.4дм3/моль = 11.2дм3
в) n(Cl2)=7.1 : 71 = 0.1моль
V(Cl2)=0.1моль*22.4дм3/моль=2.24дм3
г) n(HCl)=7.3 : 36.5 = 0.2моль
V(HCl)= 0.2моль*22.4дм3/моль=4.48дм3
1.
а) P2О5 + 3Н2О → 2Н3РО4
Реакция соединения.
б) 3Cl2 + 2Al → 2AlCl3
Реакция соединения.
в) 2NaNO3 → 2NaNO2 + O2↑
Реакция разложения.
г) 2KBr + Cl2 → 2KCl + Br2↑
Реакция замещения.
д) 3K2O + 2H3PO4 → 2K3PO4 + 3H2O
Реакция обмена.
2.
а) Реакция соединения:
4B + 3O2 → 2B2O3
B2O3 - сложное вещество, оксид бора.
б) Реакция соединения:
2Al + N2 → 2AlN
AlN - сложное вещество, нитрид алюминия.
в) Реакция замещения:
3FeO + 2Al → Al2O3 + 3Fe
FeO - сложное вещество, оксид железа(II);
Al2O3 - сложное вещество, оксид алюминия.
г) Реакция разложения(электролиз):
2Al2O3 → 4Al + 3O2
Al2O3 - сложное вещество, оксид алюминия.
3.
Дано:
m(K)=15.6 г
m(K2O)-?
1 Уравнение реакции:
4K + O2 -> 2K2O
2 Найдем количество калия:
n=m/M
M(K)=39 г/моль
n(K)=15.6/39=0.4 моль
3 По уравнению:
n(K2O)=1/2n(K)=0.2 моль
4 Найдем массу оксида калия:
m=n×M
M(K2O)=39×2+16=94 г/моль
m(K2O)=0.2×94=18.8 г
ответ: 18.8 г.
4. Протекание химических реакций осуществляется при образовании маллодиссоциирующего вещества:
Осадка, воды, газа.
При смешивании двух растворов выделение воды будет незаметно, наиболее показательно идут реакции с выпадением осадков, которые могут иметь характерный цвет и консистенцию(к примеру, гидроксид меди голубого цвета, а хлорид серебра творожистый, белого цвета), и образованием газа с резким запахом(например, газ аммиак, с характерным ему ощутимым запахом нашатырного спирта), но даже если газ не имеет запаха и цвета, есть методы, с которых можно определить присутствие того или иного газа.
В таком случае можно говорить о необратимости происходящей реакции.
Пример реакции с выпадением осадка:
2NaOH + CuCl2 -> Cu(OH)2⬇️ + 2NaCl
С образованием газа, воды:
K2CO3 + 2HNO3 -> 2KNO3 + H2O + CO2⬆️
С выделением воды:
Ba(OH)2 + 2HBr -> BaBr2 + 2H2O
Во всех заданиях даны массы газов и сами газы. Вообще, V находится по формуле 1)V=n*Vm, где n – кол-во газа, а Mr – молярная масса газа. А кол-во рассчитаем так: 2)n=m/Mr. Теперь подставим это выражение в 1 формулу и получим V=m*Vm/Mr. Будем использовать полученную формулу в решении следующих задач.
А) Масса аммиака равна 1,7 грамм. V(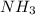 )=m(
)=m(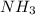 )*Vm/Mr(
)*Vm/Mr(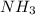 )=1,7*22,4/17=2,24 л.
)=1,7*22,4/17=2,24 л.
Б) Масса водорода равна 1 грамм. Рассчитаем объем:
V(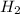 )=m(
)=m(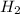 )*Vm/Mr(
)*Vm/Mr(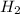 )=1*22,4/2=11,2 л.
)=1*22,4/2=11,2 л.
В) Масса хлора равна 7,1 грамм. Объем равен:
V(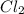 )=m(
)=m(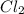 )*Vm/Mr(
)*Vm/Mr(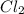 )=7,1*22,4/71=2,24 л.
)=7,1*22,4/71=2,24 л.
Г) Масса хлороводорода равна 7,3 грамм. Его объем равен:
V(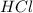 )=m(
)=m(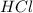 )*Vm/Mr(
)*Vm/Mr(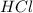 )=7,3*22,4/36,5=4,48 л.
)=7,3*22,4/36,5=4,48 л.