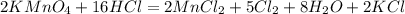K+¹Mn+⁷O₄⁻² + H+¹Cl-¹ = Mn+²Cl₂-¹ + Cl₂⁰ + K+¹Cl-¹ + H₂⁺¹O-²
Mn+⁷ + 5ē -> Mn+² │5│2 - окислитель
2Cl-¹ - 2•1ē -> 2Cl⁰ │2│5 - восстановитель
2KMnO₄ + 16HCl = 2MnCl₂ + 5Cl₂ + 2KCl + 8H₂O
Соль кальция (карбонат кальция) под действием температуры разлагается на два вещества, одно (оксид кальция) из которых при взаимодействии с водой образует «известковое молоко» (гидроксид кальция), пропустив через которое второе (углекислый газ) вещество от реакции термического разложения, можно получить опять вещество А.
а) А - CaCO₃, B - CaO, C - Ca(OH)₂, D - CO₂.
b) Ca(OH)₂ + CO₂ ⇒ CaCO₃↓ + H₂O (при дальнейшем пропускании углекислого газа образуется гидрокарбонат кальция, который в дальнейшем начнёт растворятся в воде).
с) Рассмотрим соль - CaCO₃. В его состав входят карбонат-ион (анион) и кальций-ион (катион).
Ионы кальция окрашивают пламя в кирпично-красный цвет. Поэтому и цвет пламени будет кирпично-красного цвета.

Сами полуреакции:
Полуреакция восстановления: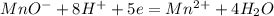 *2
*2
Полуреакция окисления: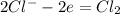 *5
*5
В ионном виде:
В молекулярном: