73 г Х л
2HCl + Na2CO3 = 2NaCl + CO2 + H2O
n = 2 моль n = 1 моль
Mr = 36 г/моль Vm = 22,4 л/моль
m = 72 г V = 22,4 л
73 г HCl - Х л СО2
72 г HCl - 22,4 л СО2
V(CO2) = 73 * 22,4 / 72 = 22,7 л
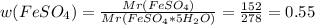 Нашли, что дальше?
Нашли, что дальше?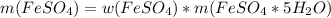 = 0,55*3,5 г.
= 0,55*3,5 г.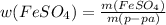 = 1,9г/43,5г = 0,0439 или 4,39% примерно 4,4%
= 1,9г/43,5г = 0,0439 или 4,39% примерно 4,4%
m(HCl) = 73 г
V(CO2) - ?
M(HCl) = 36,5 г/моль
n(HCl) = m(HCl)/M(HCl)
n(HCl) = 73 г/36,5 г/моль = 2 моль
Vm = 22,4 л/моль
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
Из уравнения реакции следует, что
n(CO2) = ¹/₂n(HCl)
n(CO2) = 2 моль/2 = 1 моль
V(CO2) = Vm×n(CO2)
V(CO2) = 22,4 л/моль×1 моль = 22,4 л
ответ: 22,4 л