Дано:
m(р-ра NaOH) = 50 гр
ω(NaOH) = 10%
Найти:
m(C₁₇H₃₅-COONa) - ?
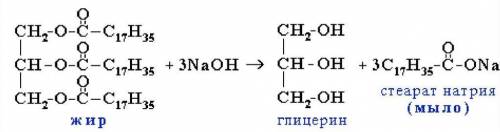
1) Для начала мы напишем уравнение реакций, то что известно по условию задачи, именно по такой уравнений реакций мы будем пользоваться. Уравнение этой реакций представлен внизу↓.
2) Далее находим массу чистого вещества у гидроксида натрия, а потом его количества вещества, и потом количества вещества у образовавшейся соли по уравнению реакций:
m(NaOH) = (m(р-ра NaOH)×ω(NaOH))/100% = (50 гр × 10%)/100% = 50 гр × 0,1 = 5 гр
M(NaOH) = 23 + 16 + 1 = 40 гр/моль
n(NaOH) = m(NaOH)/M(NaOH) = 5 гр / 40 гр/моль = 0,125 моль
n(NaOH) : n(C₁₇H₃₅-COONa) = 3 : 3 = 1 : 1 ⇒ n(C₁₇H₃₅-COONa) = n(NaOH) = 0,125 моль - по уравнению реакций
3) Теперь находим массу образовавшейся соли:
M(C₁₇H₃₅-COONa) = 12×18 + 1×35 + 16×2 + 23 = 216 + 35 + 32 + 23 = 306 гр/моль
m(C₁₇H₃₅-COONa) = n(C₁₇H₃₅-COONa)×M(C₁₇H₃₅-COONa) = 0,125 моль × 306 гр/моль = 38,25 гр
ответ: m(C₁₇H₃₅-COONa) = 38,25 гр
Решено от : 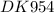
2CuO + C = Cu2O + CO
или
СuO + С = Сu + СО
Объяснение:
Реакция оксида меди двухвалентного с углеродом проходит так, как указано в вопросе, однако можно встретить и менее типичную реакцию в некоторых источниках.
Это значит, что это не реакция ионного обмена, а окислительно-восстановительная реакция, в которой два вещества должны изменить степень окисления (один повысить, другой понизить).
Для примера: NaOH + HCl = NaCl + H2O - реакция ионного обмена.
CuSO4 + Fe = FeSO4 + Cu - Окислительно-восстановительная реакция, так как железо и медь поменяли степень окисления.
При ОВР должен выпасть осадок, выделится газ или вода.
Распишем нашу реакцию со степенями окисления:
2Cu²⁺O²⁻ + C⁰ = Сu2¹⁺O²⁻ + C²⁺O²⁻↑(угарный газ)
Аналогично:
Cu²⁺O²⁻ + C⁰ = Сu⁰ ↓(осадок)+ C²⁺O²⁻ ↑(угарный газ)
Теперь определим восстановитель и окислитель:
Медь имела заряд 2+, стала 1+ - понизила свою степень окисления, поэтому окислитель, но процесс восстановление.
Углерод имел заряд 0, а стал 2+ - повысил свою степень окисления, поэтому восстановитель, но процесс окисление.
Или
Медь имела заряд 2+, стала 0 - понизила свою степень окисления, поэтому окислитель, но процесс восстановление.
Углерод имел заряд 0, а стал 2+ - повысил свою степень окисления, поэтому восстановитель, но процесс окисление.
Составим запись по стандартам ОГЭ и ЕГЭ:
Сu²⁺ +1e(электрон) Cu¹⁺ - окислитель
C⁰ (-2е) C²⁺ - восстановитель
Или
Сu²⁺ +2e(электрон) Cu⁰ - окислитель
C⁰ (-2е) C²⁺ - восстановитель
Как находится число электронов?
Из степени окисления в левой части вычитаем степень окисления правой. Нужно проявить особую осторожность с такими веществами, как H₂, P₄, Cl₂ (и другими простыми с индексами), так как индекс меняет число электронов.
Зачем нам вообще это число электронов?
Оно уравнять реакцию. Число электронов у восстановителя ставим перед окислителем в левой части уравнения и наоборот.
Но если числа чётные - их необходимо сократить.
Правильность нашего уравнивания проверяем, считая количество вошедших и вышедших веществ:
На входе 2 меди, 2 кислорода и один углерод, на выходе: 2 меди, 2 кислорода и 1 углерод, следовательно, реакцию ионного обмена мы записали правильно.
Или
На входе: 1 медь, 1 кислород и один углерод, на выходе: 1 медь, 1 кислород и 1 углерод, следовательно, реакцию ионного обмена мы записали правильно.
Надеюсь, решение достаточно подробное.
2Na+
2Ag+
Fe+
Чем галоген активнее, тем скорее он вытеснит менее активный. Например, реакция
P.S. Грубо говоря, более активные галогены в таблице выше, т.е. по убыванию F>Cl>Br>I