Привет
Начнем с конца.
CuSO4+ 2NaOH = Cu(OH)2 + Na2SO4
m(р-ра) = 48 г
w(р-ра) = 10%
m(CuSO4) = 48×0.1= 4.8 грамм
n(CuSO4) = 4.8/160= 0.03 моль
Так как CuSO4 и NaOH находятся в молярном соотношении 1 к 2, то следует:
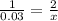
x= 0.06 моль NaOH
При электролизе раствора NaOH выделяется 3 моль газов (2H2 и O2) , но по задаче даётся 134.4 литра
Газы выделяются потому что электролизуется Вода
NaOH не электролизуется
2H2O =(электролиз) 2H2 + O2
При электролизе 2 моль воды, выделятся и улетучивается 3 моль газов, но по задаче даётся 134.4 литра, а это 134.4/22.4 = 6 моль газов
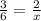
x= 4 моль воды электролизовалось
120×0.1= 12 грамм NaOH
120-12= 108 грамм воды
Так как 72 грамм воды электролизовалось (4×18=72), масса раствора оказалась: 120-72 = 48 грамм
В растворе содержится 12 грамм NaOH
Моль NaOH = 12/40 = 0.3 моль
На осаждение CuSO4 использовали 0.06 моль NaOH
m(NaOH) = 0.06 × 40= 2.4 грамм
Вопрос задачи: Вычислите какую часть (%) раствора использовались для осаждения CuSO4
Масса раствора была 48 грамм - это 100%, 2.4 грамм - X
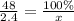
x= 5%
ответ: 5%
Если будут вопросы, отпишитесь в комментариях
2H(+) +2NO3(-) + Ba(+2) +2OH(-) →Ba(+2) +2NO3(-) + 2H2O
2H(+) +2OH(-) → 2H2O
H(+) +OH(-) → H2О
б) CuCl2 + Ca(OH)2 →Cu(OH)2 + CaCL2
Cu(+2) +2Cl(-) + Ca(+2) +2OH(-) →Cu(OH)2 +Ca(+2) +2CL(-)
Cu(+2) +2OH(-) →Cu(OH)2
в) FeSO4 + HCl →не пойдет реакция