№1:
а - 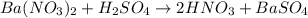
б - 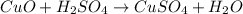
в - 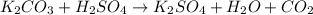
г - 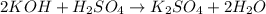
Про тесения реакций - извини, не очень понял, что требуется?
№3
Качественная реакция на сульфат - анион есть реакция с катионами бария: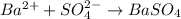 - выпадает белый осадок сульфата бария, такая реакция есть в задании №1 под пунктом - а
- выпадает белый осадок сульфата бария, такая реакция есть в задании №1 под пунктом - а
№4 В обе пробирки добавить несколько мл гидроксида бария. В пробирке с соляной кислотой пройдет обычная нейтрализация, видимых изменений не наблюдается, а в пробирке с серной кислотой выпадет белый осадок сульфата бария(ионные уравнения приведены выше)
Дано:
m(Fe)=100г.
m₁(Fe)=101,3г.
m(Cu)-?
1. CuSO4 + Fe → FeSO4 + Cu
2. Сколько железа растворилось (окислилось) и ушло в раствор в виде ионов, столько же ионов меди восстановилось до свободной меди и выделилось на железной пластине.
3.
Точная молярная масса железа: M( Fe) = 55,847 г/моль
Точная молярная масса меди: M(Cu) = 63,546 г/моль
4.По уравнению реакции в раствор уйдет 1 моль железа, то его место займет 1 моль элементарной меди, и масса пластины увеличится на разность молекулярных масс меди и железа
m₃ = 63,546г./моль - 55,847г./моль = 7,699 г/моль округлим 7,7г./моль
5. По условию задачи масса увеличилась на: m₄ = 101,3 -100=1,3г
6. Определим количество вещества меди заместившей железо:
n(Cu) = m₄÷m₃ =1,3г ÷ 7,7г/моль = 0,169 моль
7. Определим массу выделившейся меди:
m(Cu)= n(Cu)×M(Cu) =0,169 моль х 63,546 г/моль =10,73 г
8. ответ: на пластине образовалось 10,73 грамма меди,
соответственно в раствор перешла масса железа:
n(Fe) = m₄÷m₃ =1,3г ÷ 7,7г/моль = 0,169 моль
m(Fe)=n(Fe)хM(Fe)=0,169 моль х 55,847 г/моль = 9,43 г
Проверим:
100 г железной пластины - 9,43 г железа + 10,73 г меди = 101,3 грамма