m₁ (H₂SO₄) = 200 г
V₁ ₚ₋ₚ = 1 л
m (Zn) = 0,5 г
V₂ ₚ₋ₚ = ?
Решение://Составляем уравнение и проверяем в нём все коэффициенты//
Zn + H₂SO₄ = ZnSO₄ + H₂↑
1) n(Zn) = m(Zn) : M(Zn);
0,5 г : 65 г/моль = 0,008 моль
2) //Чтобы найти n(H₂SO₄), смотрим на коэффициенты в уравнении, которые показывают, как кол-во одного вещества относится к кол-ву другого//
n(Zn) : n(H₂SO₄) = 1 : 1 ==> n(H₂SO₄) = n(Zn) = 0,008 моль
3) m(H₂SO₄) = n(H₂SO₄) • M(H₂SO₄);
m₂(H₂SO₄) = 0,008 моль (2 + 32 + (16 • 4)) = 0,008 • 98 г/моль = 0,784г
4) //Если в 1 литре первого раствора по условию содержится 200 г цинка, то чтобы найти объём второго раствора с 0,5 г, нужно составить пропорцию//
V₁ ₚ₋ₚ = 1л = 1000 мл; m₁ = 200 г; V₂ ₚ₋ₚ = х мл; m₂ = 0,784г
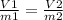 ==>
==> 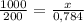
200x = 1000 • 0,784;
200x = 784;
х = 784 : 200;
х = 4
ответ:4 мл или 0,004 л
1. Наименьшая частица химического элемента, являющаяся носителем его свойств:
А) молекула
2. Вещество, имеющее химическую формулу КNОз ,называется:
А) нитрат калия
3. Электронная формула 1s22s22p63s23p3 соответствует атому:
В) фосфор
4. В третьем периоде в четвертой группе находится элемент с порядковым номером:
А) 14
5. Формулы высшего оксида и соответствующего ему гидроксида элемента азота:
В) N205 и НNОз
6. Связь, осуществляемая одной или несколькими общими электронными парами, называется:
Б) ковалентная
7. Степень окисления элемента серы в соединении Nа2 S0з равна:
В) +6
8. Переход системы из одного равновесного состояния в другое называется-: А)смещением химического равновесия
9. Катион металла и анион кислотного остатка образуются при диссоциации:
Г) NaCl
10. Реакция ионного обмена, в результате которой образуется осадок, это реакция между:
В) АgNОз и HCl
11. При содержании 20 г. вещества в 200 г. раствора, массовая доля вещества составит:.
В) 0,1
12. Вещество, которое в ходе химической реакции отдает электроны, это: Б) восстановитель
13. Вещество, которое реагирует с водой с образованием щёлочи и водорода при нормальных условия:
Г) щелочной металл Na
14. Электролизом в промышленности получают:
Б) активные металлы (магний)
15. В порядке усиления неметаллических свойств химические элементы расположены в ряду:
А) P-S-Cl
16. Углеводороды циклического строения:
В) циклоалканы, ароматические
17. Углеводороды с одинарными связями, содержащие атомы углерода в состоянии SР3-гибридизации: А) алканы
18. Общая формула C n H 2n-2 соответсвует углеводородам:
В) алкины
19. Характерные реакции для насыщенных предельных углеводородов: А) замещения
20. Кислородорганические соединения, обладающие свойствами неорганических кислот
В)карбоновые кислоты